题目内容
【题目】化学能在一定条件下可转化为电能。
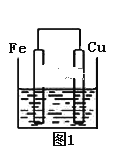
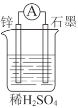
(1)如图所示装置中锌片是______(填“正极”或“负极”),其电极反应式是______。溶液中H+移向______(填“锌”或“石墨”)电极。
(2)下列反应通过原电池装置,可实现化学能直接转化为电能的是______(填序号)。
①2H2+O2=2H2O②HCl+NaOH=NaCl+H2O
【答案】负极 Zn-2e-=Zn2+ 石墨 ①
【解析】
该装置为原电池装置,锌与硫酸发生氧化还原反应,故锌作负极,石墨作正极;能形成原电池的反应必须为氧化还原反应。
(1)综上分析锌片是负极,锌失电子发生氧化反应生成锌离子,其电极反应式是Zn-2e-=Zn2+,溶液中的阳离子移向正极,故溶液中H+移向石墨电极。
(2)构成原电池装置的反应必须为自发的氧化还原反应,①2H2+O2=2H2O为氧化还原反应,而②HCl+NaOH=NaCl+H2O为非氧化还原反应,故通过原电池装置,可实现化学能直接转化为电能的是①。

【题目】Ⅰ.在实验室利用下列装置,可制备某些气体并验证其化学性质。

完成下列表格:
序号 | 气体 | 装置连接顺序(填字母) | 制备反应的化学方程式 |
(1) | 乙烯 | B→D→E | ___ |
(2) | 乙炔 | ___ | ___ |
(3)D装置中氢氧化钠溶液的作用___。
Ⅱ.工业上用乙烯和氯气为原料,经下列各步合成聚氯乙烯(PVC):
乙烯![]() 甲
甲![]() 乙
乙![]() PVC
PVC
(4)甲的结构简式是___;
(5)反应③的化学方程式是__。
(6)下列说法正确的是___。
A.乙烯可以作为植物生长调节剂
B.PVC不能使酸性高锰酸钾溶液褪色
C.PVC中的官能团是碳碳双键和氯原子
【题目】分别向等体积的不含O2、含有O2的0.1mol·L1BaCl2溶液中通入SO2,探究体系中物质间的相互作用,实验记录如下。(已知:pH越小,溶液酸性越强)
pH变化 |
|
溶液中是否产生沉淀 | 不含O2的BaCl2溶液中没有白色沉淀,含有O2的BaCl2溶液中产生白色沉淀。 |
下列说法不正确的是
A.a所示溶液的pH降低的原因:SO2与H2O反应生成H2SO3,溶液的c(H+)增大
B.b所示溶液中发生反应:2Ba2++O2+2SO2+2H2O=2BaSO4↓+4H+
C.b比a所示溶液的pH小的原因:Ba2++SO2+H2O=BaSO3↓+2H+
D.SO2通入不含O2的BaCl2溶液后,再通入NH3,产生BaSO3沉淀