题目内容
【题目】下表为元素周期表的一部分,

请参照元素A~H在表中的位置,用化学用语回答下列问题:
(1)D、E、F的原子半径由大到小的顺序为_______________________________。
(2)B、C、D的第一电离能由大到小的顺序为_____________________________。
(3)A、D、E、H中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:______________________。
(4)E、F的最高价氧化物的水化物相互反应的离子方程式:__________________。
(5)在B所形成的化合物CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有______________;与CO分子互为等电子体的分子和离子分别为________和________,根据等电子理论推测CO分子的结构式可表示成________,一个CO分子中有________个σ键,________个π键。
(6)根据价电子对互斥理论预测D和H所形成的HD的空间构型为_________形。
【答案】 Na>Al>O N>O>C ![]() Al(OH)3+OH-===[Al(OH)4]- CH4、CH3OH N2 CN—(或C
Al(OH)3+OH-===[Al(OH)4]- CH4、CH3OH N2 CN—(或C![]() 或NO+) C≡O 1 2 正四面体
或NO+) C≡O 1 2 正四面体
【解析】根据元素在周期表中的位置可知,A、B、C、D、E、F、G、H分别为H、C、N、O、Na、Al、Si、Cl。
(1) 同周期从左到右,原子半径逐渐减小,同主族,从上到下,原子半径逐渐增大,
D、E、F的原子半径由大到小的顺序为Na>Al>O,故答案为:Na>Al>O;
(2) 同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素的第一电离能大于相邻元素。B、C、D的第一电离能由大到小的顺序为N>O>C,故答案为:N>O>C;
(3) H、O、Na、Cl中的某些元素可形成既含离子键又含极性共价键的化合物,如氢氧化钠,次氯酸钠等,电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(4)氢氧化钠和氢氧化铝反应的离子方程式为Al(OH)3 + OH-== AlO2- +2H2O,故答案为:Al(OH)3 + OH-== AlO2- +2H2O;
(5)化合物CH4为正四面体结构,采取sp3杂化;CO为直线结构,采取sp杂化;CH3OH可以看出甲烷中的氢原子被羟基取代的产物,碳原子采取sp3杂化;与CO分子互为等电子体的分子和离子分别为N2、CN—或C22-;根据等电子理论推测CO分子的结构与氮气相似,结构式为C≡O;一个CO分子中有1个σ键,2个π键,故答案为:CH4、CH3OH;N2、CN—或C22-;C≡O;1;2;
(6)ClO4-中Cl的价层电子对数=4+![]() ×(7+1-4×2)=4,采取sp3杂化,空间构型为正四面体形,故答案为:正四面体。
×(7+1-4×2)=4,采取sp3杂化,空间构型为正四面体形,故答案为:正四面体。

【题目】氯气及其化合物在生产生活中有重要的应用。
(1)可用O2将HCl转化为Cl2:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)。已知相关化学键的键能如下表所示
化学键 | H-Cl | O=O | Cl – Cl | H-O |
E(kJ·mol-1 | a | b | c | d |
则该反应的△H=______________。(用含a、b、c、d的代数式表示)
(2)氯气是有机合成中的重要试剂,丙烯(CH2=CHCH3)和Cl2在一定条件下发生如下反应: CH2=CHCH3 (g)+Cl2(g) ![]() CH2=CHCH2Cl(g)+HCl(g)。一定压强下,该反应在不同温度、不同投料比时,达平衡时Cl2的转化率如图所示(T12< T3)
CH2=CHCH2Cl(g)+HCl(g)。一定压强下,该反应在不同温度、不同投料比时,达平衡时Cl2的转化率如图所示(T12< T3)
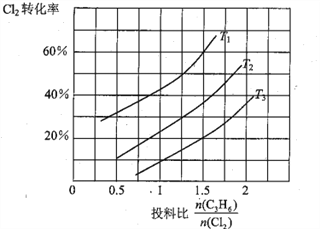
①该反应的△H______________0(填“>”或“<”)
②下列措施能增大丙烯的平衡转化率的是______________ (填标号)。
A.降低温度 B.减小容器的体积
C.使用新型催化剂 D.从容器中移走氯化氢
③T1时,在容积为5L的密闭容器中充入0.15mol丙烯和0.10 molCl2,10min时达到平衡,则v(Cl2)为______________mol·〔L·min)-1,平衡常数K为______________,保持温度不变,减小投料比![]() ,K值将______________ (填“增大”“减小”或“不变”);若起始时向该容器中充入0.30mol丙烯、0.20 molCl2、0.15 mol CH2=CHCH2Cl和0.30 molHCl,判断反应进行的方向并说明理由____________________________。
,K值将______________ (填“增大”“减小”或“不变”);若起始时向该容器中充入0.30mol丙烯、0.20 molCl2、0.15 mol CH2=CHCH2Cl和0.30 molHCl,判断反应进行的方向并说明理由____________________________。
④上述反应在低于某温度时,CH2=CHCH2Cl的产率快速下降,可能的原因是____________________________。