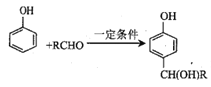
题目内容
【题目】镁铝碱式碳酸盐MgaAlb(OH)c(CO3)d·xH2O是一种不溶于水的新型无机阻燃剂,其受热分解产物中的MgO、Al2O3熔点较高且都不燃烧,有阻燃作用。
完成下列填空:
(1).组成镁铝碱式碳酸盐的三种非金属元素的原子半径从小到大的顺序是______________。碳原子最外层电子排布式是_______________________________,铝原子核外有_________种能量不同的电子。
(2).将MgaAlb(OH)c (CO3)d·x H2O表示成氧化物的形式:2aMgO·bAl2O3·2dCO2·((______))H2O;焦炭与石英高温下在氮气流中发生如下反应,工业上可由此制得一种新型陶瓷材料氮化硅(Si3N4) :3SiO2(s)+6C(s)+2N2(g)![]() Si3N4(s)+6CO(g) + Q (Q>0)
Si3N4(s)+6CO(g) + Q (Q>0)
(3).该反应中,氧化产物是________________________。若测得反应生成4.48 L CO气体(标准状况下),则转移的电子的物质的量为_____________。
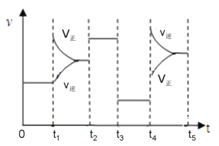
(4).该反应的平衡常数表达式K=_____________________________;若升高温度,K值____________(填“增大”、“减小”或“不变”)。该反应的速率与反应时间的关系如图所示,t4时刻引起正逆速率变化的原因是___________________________(写出一种即可)。
【答案】 H<O<C 2s22P2 5 (2x+c) 一氧化碳 0.4mol [c(CO)]6/[c(N2)]2 减小 升高温度(加压、缩小容器体积等)
【解析】(1)组成镁铝碱式碳酸盐的三种非金属元素为C、H、O,H原子半径最小,同一周期,从左到右,原子半径逐渐减小,因此原子半径从小到大的顺序为H<O<C;C为6号元素,碳原子最外层电子排布式是2s22p2;Al核电荷数为13,具有3个电子层,最外层电子数为3,核外电子排布式为:1s22s22p63s23p1,具有1s、2s、2p、3s、3p共5种能量不同的电子,故答案为:H<O<C;2s22p2;5。
(2)MgaAlb(OH)c(CO3)dxH2O写出氧化物形式为:aMgO![]() Al2O3dCO2
Al2O3dCO2![]() H2O或2aMgObAl2O32dCO2(c+2x)H2O,故答案为:c+2x。
H2O或2aMgObAl2O32dCO2(c+2x)H2O,故答案为:c+2x。
(3)根据方程式3SiO2(s)+6C(s)+2N2(g)![]() Si3N4(s)+6CO(g),反应中C元素化合价升高,被氧化,氧化产物为CO;生成6molCO时,转移电子的物质的量是12mol,当生成4.48L(即0.2mol)CO气体(标准状况下),转移电子0.4mol,故答案为:一氧化碳;0.4mol。
Si3N4(s)+6CO(g),反应中C元素化合价升高,被氧化,氧化产物为CO;生成6molCO时,转移电子的物质的量是12mol,当生成4.48L(即0.2mol)CO气体(标准状况下),转移电子0.4mol,故答案为:一氧化碳;0.4mol。
(4)3SiO2(s)+6C(s)+2N2(g)![]() Si3N4(s)+6CO(g) + Q (Q>0),该反应的平衡常数表达式K=
Si3N4(s)+6CO(g) + Q (Q>0),该反应的平衡常数表达式K=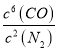 ;正反应为放热反应,升高温度,平衡逆向移动,K值减小。根据反应的速率与反应时间的关系图可知,t 4时刻逆反应速率和正反应速率均增大,但逆反应反应速率大于正反应速率,平衡逆向移动,说明改变的条件为升高温度,故答案为:
;正反应为放热反应,升高温度,平衡逆向移动,K值减小。根据反应的速率与反应时间的关系图可知,t 4时刻逆反应速率和正反应速率均增大,但逆反应反应速率大于正反应速率,平衡逆向移动,说明改变的条件为升高温度,故答案为: 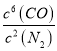 ;减小;升高温度。
;减小;升高温度。

 孟建平名校考卷系列答案
孟建平名校考卷系列答案