题目内容
16.有A、B、C、D、E五种微粒:①A微粒核内有12个中子,核外M电子层上有1个电子;
②B微粒得到2个电子后,其电子层结构与Ne相同;
③C微粒带有2个单位的正电荷,核电荷数为12;
④D微粒核外有18个电子,当失去2个电子时呈电中性;
⑤E微粒不带电,其质量数为1.
(1)请写出各微粒的符号:A23Na、BO、CMg2+、DS2-、E1H;
(2)A、D两元素形成的化合物属于离子晶体,电子式
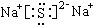 ,
,(3)B、E两种元素的原子之间可以通过共价键(填化学键的名称)形成化合物的化学式有H2O、H2O2.
分析 (1)根据电子数、核电荷数、电荷数的关系判断元素;
(2)A、D两元素形成硫化钠;
(3)B、E两种元素的原子之间可以形成H2O、H2O2.
解答 解:(1)①由“核外M电子层上有1个电子”知,该元素的核外电子排布为2、8、1,质子数为11,质量数为23;所以是23Na;
②Ne的核外电子数是10,B微粒得到2个电子后,其电子层结构与Ne相同,所以B是O元素;
③C的核电荷数为12,C微粒带有2个单位的正电荷,核电荷数=原子序数,所以C是镁离子;
④由题意知,该元素的原子核外有16个电子,原子的核外电子数=核内质子数=原子序数,所以D是硫离子;
⑤由题意知,E是质子数为1,中子数为0,质量数为1的H元素.
故答案为:23Na;O;Mg2+;S2-;11H;
(2)A、D两元素形成硫化钠,属于离子晶体,电子式: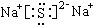 ,故答案为:离子;
,故答案为:离子;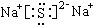 ;
;
(3)B、E两种元素的原子之间可以形成H2O、H2O2,两种元素间形成共价键,故答案为:共价键;H2O、H2O2.
点评 本题考查了原子核外电子排布及质子数、中子数、质量数的相互关系和离子晶体、化学键等知识点,侧重考查学生对这些知识点的掌握情况.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
6.0.5L AlCl3溶液中Cl-为9.03×1022个,则AlCl3溶液的物质的量浓度为( )
| A. | 0.1 mol•L-1 | B. | 1 mol•L-1 | C. | 3 mol•L-1 | D. | 1.5 mol•L-1 |
4.可以证明烧杯中的硝酸钾溶液是饱和溶液的方法是( )
| A. | 蒸发掉1克水,有少量固体析出 | B. | 降低温度,有少量固体析出 | ||
| C. | 加入少量硝酸钾固体,固体不溶解 | D. | 加入少量水,没有固体析出 |
11.X22-离子共有2n个电子,元素X的原子核内的质子数为( )
| A. | n-1 | B. | n+1 | C. | n | D. | 2n |
1.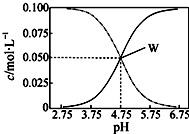 25℃,有c(CH3COOH)+c(CH3COO-)=0.1mol/L的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示.有关离子浓度关系分析正确的是( )
25℃,有c(CH3COOH)+c(CH3COO-)=0.1mol/L的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示.有关离子浓度关系分析正确的是( )
 25℃,有c(CH3COOH)+c(CH3COO-)=0.1mol/L的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示.有关离子浓度关系分析正确的是( )
25℃,有c(CH3COOH)+c(CH3COO-)=0.1mol/L的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示.有关离子浓度关系分析正确的是( )| A. | pH=5.5溶液中:c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) | |
| B. | W点表示溶液中:c(Na+)+c(H+)=c(CH3COO-)+c(CH3COOH) | |
| C. | pH=3.5溶液中:c(Na+)-c(OH-)+c(CH3COOH)=0.1 mol/L | |
| D. | 向W点所表示溶液中通入0.05molHCl气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH-) |
5.如图所示装置,肯定不符合气密性要求的是( )
| A. | 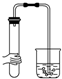 | B. |  | C. | 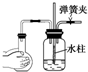 | D. | 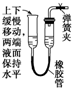 |
6.人生病时要合理用药.下列药品与其作用相匹配的是( )
| A. | 氢氧化铝:麻醉剂 | B. | 阿司匹林:消炎抗菌 | ||
| C. | 麻黄碱:止咳平喘 | D. | 青霉素:解热镇痛 |
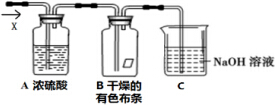 某同学应用如图所示装置研究物质的性质.其中气体X的主要成分是氯气,还含有少量空气和水蒸气.请回答下列问题:
某同学应用如图所示装置研究物质的性质.其中气体X的主要成分是氯气,还含有少量空气和水蒸气.请回答下列问题: