题目内容
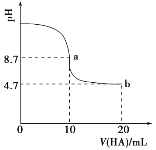
【题目】实验测得0.1mo1·L-1Na2SO3溶液pH随温度升高而变化的曲线如图所示。将b点溶液冷却至25℃,加入盐酸酸化的BaC12溶液,能明显观察到白色沉淀。下列说法正确的是( )

A.Na2SO3溶液中存在水解平衡SO32-+2H2O![]() H2SO3+2OH-
H2SO3+2OH-
B.温度升高,溶液pH降低的主要原因是SO32-水解程度减小
C.a、b两点均有c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)]
D.将b点溶液直接冷却至25℃后,其pH小于a点溶液
【答案】D
【解析】
![]() 是一个弱酸酸根,因此在水中会水解显碱性,而温度升高水解程度增大,溶液碱性理论上应该增强,但是实际上碱性却在减弱,这是为什么呢?结合后续能产生不溶于盐酸的白色沉淀,因此推测部分
是一个弱酸酸根,因此在水中会水解显碱性,而温度升高水解程度增大,溶液碱性理论上应该增强,但是实际上碱性却在减弱,这是为什么呢?结合后续能产生不溶于盐酸的白色沉淀,因此推测部分![]() 被空气中的氧气氧化为
被空气中的氧气氧化为![]() ,据此来分析本题即可。
,据此来分析本题即可。
A.水解反应是分步进行的,不能直接得到![]() ,A项错误;
,A项错误;
B.水解一定是吸热的,因此越热越水解,B项错误;
C.温度升高溶液中部分![]() 被氧化,因此写物料守恒时还需要考虑
被氧化,因此写物料守恒时还需要考虑![]() ,C项错误;
,C项错误;
D.当b点溶液直接冷却至25℃后,因部分![]() 被氧化为
被氧化为![]() ,相当于
,相当于![]() 的浓度降低,其碱性亦会减弱,D项正确;
的浓度降低,其碱性亦会减弱,D项正确;
答案选D。

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目