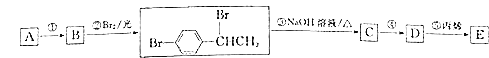题目内容
【题目】高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示:
湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如图所示:
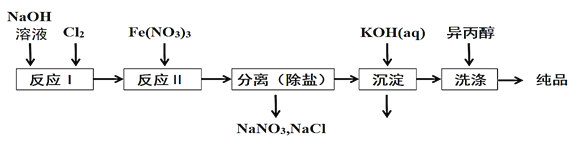
①洗涤粗品时选用异丙醇而不用水的理由是:________。
②反应II的离子方程式为___________。
③高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂.它能消毒杀菌是因为_______它能净水的原因是_______。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾。
①加入饱和KOH溶液的目的是:__________。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠____(填“大”或“小”)。
(3)干法制备K2FeO4的反应中氧化剂和还原剂的物质的量之比________
【答案】减少高铁酸钾的溶解损失 3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O 高铁酸钾具有强氧化性 高铁酸钾的还原产物水解生成氢氧化铁胶体,具有吸附性,可以净水 增大K+浓度,促进K2FeO4晶体析出 小 3:1
【解析】
(1)①洗涤粗品时用水主要是减少高铁酸钾的溶解损失。②反应II是在强碱性介质中,Fe(NO3)3与NaClO反应生成氯离子、高铁酸根。③高铁酸钾在水中能消毒杀菌是因为高铁酸钾中铁处于+6价,化合价易降低,高铁酸钾的还原产物铁离子水解生成氢氧化铁胶体。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾。
①加入饱和KOH溶液的目的是:从平衡移动原理理解,增大K+浓度,促进K2FeO4晶体析出,故答案为:增大K+浓度,促进K2FeO4晶体析出。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠小,故答案为:小。
(3)干法制备K2FeO4的反应是Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物,氧化铁中铁化合价升高6个,硝酸钾中氮化合价降低2个,根据升降守恒得到n(Fe2O3):n(KNO3) =1:3,因此反应中氧化剂和还原剂的物质的量之比3:1,故答案为:3:1。
(1)①洗涤粗品时选用异丙醇而不用水的理由是减少高铁酸钾的溶解损失,故答案为:减少高铁酸钾的溶解损失。
②反应II是在强碱性介质中,Fe(NO3)3与NaClO反应生成氯离子、高铁酸根,其离子方程式为3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O,故答案为:3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O。
③高铁酸钾在水中能消毒杀菌是因为高铁酸钾中铁处于+6价,化合价易降低,因此具有强氧化性,它能净水的原因是高铁酸钾的还原产物铁离子水解生成氢氧化铁胶体,具有吸附性,可以净水,故答案为:高铁酸钾具有强氧化性;高铁酸钾的还原产物水解生成氢氧化铁胶体,具有吸附性,可以净水。
(2)①向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾,利用平衡移动原理分析。
②由以上信息得出高铁酸钾的溶解度与高铁酸钠关系。
(3)干法制备K2FeO4的反应是Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物,利用化合价升降分析。

 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案