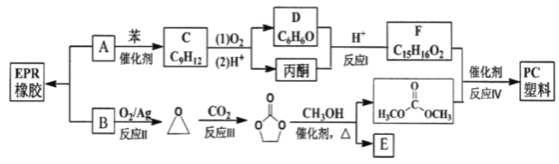
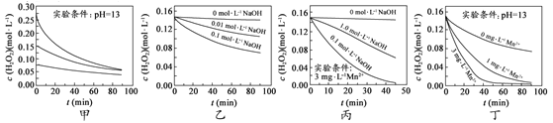
题目内容
【题目】我国化学侯德榜改革国外的纯碱生产工艺,生产流程如图所示,下列说法不正确的是( )

A. 在沉淀池中应先通入氨气,再通入二氧化碳气体
B. 该反应原理: NH3+CO2+H2O=HCO3-+NH4+
C. 循环1中X是二氧化碳
D. 在过滤后的母液中加入氯化钠粉末、通入氨气,搅拌,经冷却结晶后可得氯化铵晶体
【答案】B
【解析】
A.氨气极易溶于水,而二氧化碳微溶于水,先通入氨气,溶液呈碱性,再通入二氧化碳气体可更多地转化为HCO3-,故A正确;
B.该反应原理是:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl、2NaHCO3![]() Na2CO3+CO2↑+H2O,故B错误;
Na2CO3+CO2↑+H2O,故B错误;
C.碳酸氢钠受热分解生成碳酸钠、CO2和水,可将CO2通入沉淀中循环利用,故X为CO2,故C正确;
D.在过滤后的母液中加入氯化钠粉末、通入氨气,搅拌,增大了铵根离子的浓度,使氯化铵更多的析出,经冷却结晶后可得氯化铵晶体,故D正确。答案选B。

练习册系列答案
相关题目