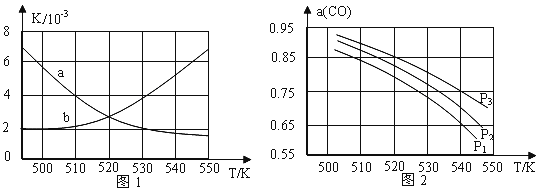
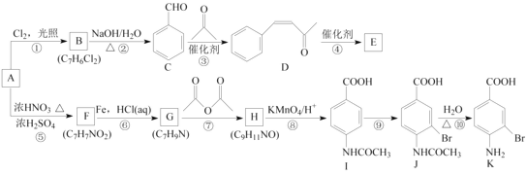
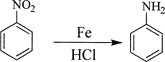
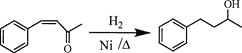
题目内容
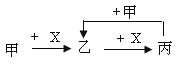
【题目】已知下列反应的热化学方程式:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)ΔH1=﹣870.3 kJ·mol-1
③ C(s)+O2(g)=CO2(g)ΔH2=﹣393.5 kJ·mol-1
④ H2(g)+![]() O2(g)=H2O(l)ΔH3=﹣285.8 kJ·mol-1
O2(g)=H2O(l)ΔH3=﹣285.8 kJ·mol-1
则2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热为( )
A.﹣870.3 kJ·mol-1B.﹣571.6 kJ·mol-1
C.+787.0 kJ·mol-1D.﹣488.3 kJ·mol-1
【答案】D
【解析】
根据盖斯定律,③×2+④×2-①,可得2C(s)+2H2(g)+O2(g)=CH3COOH(l),则ΔH=-393.5kJ/mol×2-285.8kJ/mol×2+870.3kJ/mol=-488.3kJ/mol,答案为D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目