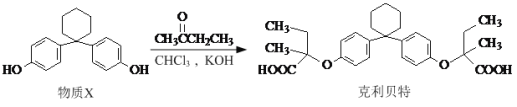题目内容
【题目】设NA表示阿伏加德罗常数的值。下列说法正确的是
A.15g14CO与15N2的混合气体所含质子数为7.5NA
B.11.2LCl2与NaOH溶液反应转移电子数为0.5NA
C.2molSO2与1mol02反应生成SO3的分子数为2NA
D.48gO2和O3的混合气体中含有3NA个氧原子
【答案】D
【解析】
A.14CO与15N2的摩尔质量都是30g·mol 1,并且1个14CO分子与1个15N2分子所含的质子数都是14,所以15 g 14CO与15N2的混合气体的物质的量为![]() =0.5mol,所含的质子数为7NA,故A错误;
=0.5mol,所含的质子数为7NA,故A错误;
B.未指明标况,无法计算11.2L Cl2的物质的量,故B错误;
C.SO2与 O2在一定条件下反应生成SO3的反应是一个可逆反应,反应物的转化率小于100%, 则2mol SO2与1mol O2反应生成SO3的分子数小于2NA,故C错误;
D. O2和O3的最简式均为O,依据最简式可知O的物质的量为![]() =3mol,所含氧原子个数为3NA个,故D正确;
=3mol,所含氧原子个数为3NA个,故D正确;
故选D。

练习册系列答案
相关题目
【题目】NaClO是漂白液的有效成分,某研究小组探究NaClO溶液的性质,设计了下列实验:
装置图 | 试剂X | 实验现象 | |
| ① | 0.2molL-1盐酸 | 产生黄绿色气体 |
② | 0.2molL-1KI-淀粉溶液 | 溶液变蓝 | |
③ | 0.2molL-1FeSO4(H+)和KSCN混合溶液 | 溶液变红 | |
④ | 0.2molL-1AlCl3溶液 | 产生白色沉淀 | |
下列判断不正确的是
A.实验①中发生的反应:ClO-+Cl-+2H+=Cl2↑+H2O
B.实验②中发生的反应:ClO-+2I-+2H+=Cl-+I2+H2O
C.实验③中该条件下氧化性强弱:ClO->Fe3+
D.实验④中ClO-与Al3+相互促进水解