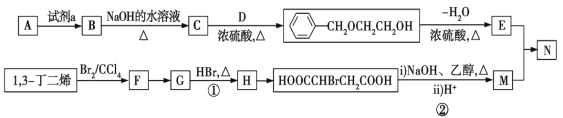
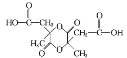
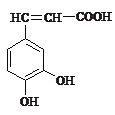
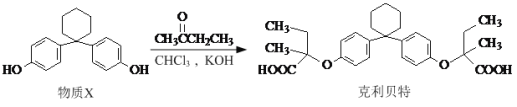题目内容
【题目】按要求回答下列问题
Ⅰ.下列物质组别中:A.冰与水 B.H2、D2、T2 C.O2与 O3 D. ![]() 与
与![]() E.CH3—CH2—CH2—CH3与
E.CH3—CH2—CH2—CH3与![]() F.
F. 与
与 G.甲烷和庚烷。
G.甲烷和庚烷。
①互为同位素的是_________(填组别选项,下同);
②互为同素异形体的是_________;
③互为同分异构体的是_________;
④属于同一物质的是_________;
⑤属于同系物的是_________。
Ⅱ.(1)乙烯使溴水褪色的反应类型和使酸性高锰酸钾溶液褪色的反应类型_______(填“相同”或“不相同”)。
(2)用苯制备溴苯的化学方程式是_____________________,该反应的类型_________。
(3)已知 2CH3CHO+O2![]() 2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如图所示。则反应②的化学方程式为______________,该反应的类型为__________。
2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如图所示。则反应②的化学方程式为______________,该反应的类型为__________。
![]()
Ⅲ.在光照条件下,CH4与Cl2能发生取代反应。若将1 mol CH4与一定量Cl2反应,待反应完全测得四种有机取代产物的物质的量之比为 n(CH3Cl)∶n(CH2Cl2)∶n(CHCl3)∶n(CCl4)=1∶1∶1∶1,则消耗的Cl2物质的量为__________。
【答案】D C E AF G 不相同 ![]() +Br2
+Br2![]()
![]() +HBr 取代反应 2CH3CH2OH+O2
+HBr 取代反应 2CH3CH2OH+O2![]() 2CH3CHO+2H2O 氧化反应 2.5 mol
2CH3CHO+2H2O 氧化反应 2.5 mol
【解析】
Ⅰ. A.冰是水的固态,与水是同种物质;
B.同位素是不同种原子的互称,H2、D2和T2是分子,不互为同位素;
C.O2与 O3是氧元素形成的不同种单质,互为同素异形体;
D.![]() 与
与![]() 的质子数相同,中子数不同,互为同位素;
的质子数相同,中子数不同,互为同位素;
E.CH3—CH2—CH2—CH3与![]() 的分子式相同,结构不同,互为同分异构体;
的分子式相同,结构不同,互为同分异构体;
F.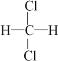 与
与 的分子式相同,结构相同,是同种物质;
的分子式相同,结构相同,是同种物质;
G.甲烷和庚烷的结构相似,相差若干个CH2原子团,互为同系物;
Ⅱ.(1)乙烯具有碳碳双键,能与溴水发生加成反应,能与酸性高锰酸钾溶液发生氧化反应;
(2)在铁或溴化铁做催化剂作用下,苯与液溴发生取代反应生成溴苯;
(3)由流程图可知,在催化剂作用下,乙烯与水发生加成反应生成乙醇,则B为乙醇;在铜或银做催化剂作用下,乙醇与氧气共热发生催化氧化反应生成乙醛,在催化剂作用下,乙醛与氧气共热发生催化氧化反应生成乙酸;
Ⅲ.在光照条件下,CH4与Cl2能发生取代反应时,氯气分子中的一半的Cl原子生成HCl,半氯原子生成氯代烃,若四种有机取代产物的物质的量之比为 n(CH3Cl)∶n(CH2Cl2)∶n(CHCl3)∶n(CCl4)=1∶1∶1∶1,计算出各自的物质的量,进而计算所需氯气的物质的量。
Ⅰ. ①同位素是质子数相同,中子数不同的原子的互称,则D互为同位素,故答案为:D;
②同素异形体是同种元素形成的不同单质的互称,则C互为同素异形体,故答案为:C;
③分子式相同,结构不同的不同物质互为同分异构体,则E互为同分异构体,故答案为:E;
④同一物质的分子式和结构完全相同,则属于同一物质的是A或F,故答案为:AF;
⑤结构相似,分子组成上相差一个若干个CH2原子团的有机物互为同系物,则G属于同系物,故答案为:G;
Ⅱ.(1)乙烯具有碳碳双键,能与溴水发生加成反应,使溴水褪色,能与酸性高锰酸钾溶液发生氧化反应,使酸性高锰酸钾溶液褪色,则反应类型不同,故答案为:不同;
(2)在铁或溴化铁做催化剂作用下,苯与液溴发生取代反应生成溴苯,反应的化学方程式为![]() +Br2
+Br2![]()
![]() +HBr,故答案为:
+HBr,故答案为:![]() +Br2
+Br2![]()
![]() +HBr;取代反应;
+HBr;取代反应;
(3)由流程图可知,在催化剂作用下,乙烯与水发生加成反应生成乙醇,则B为乙醇;在铜或银做催化剂作用下,乙醇与氧气共热发生催化氧化反应生成乙醛,在催化剂作用下,乙醛与氧气共热发生催化氧化反应生成乙酸,在铜或银做催化剂作用下,乙醇与氧气共热发生催化氧化反应生成乙醛的化学方程式为2CH3CH2OH+O2![]() 2CH3CHO+2H2O,故答案为:2CH3CH2OH+O2
2CH3CHO+2H2O,故答案为:2CH3CH2OH+O2![]() 2CH3CHO+2H2O;氧化反应;
2CH3CHO+2H2O;氧化反应;
Ⅲ.在光照条件下,CH4与Cl2能发生取代反应时,氯气分子中的一半的Cl原子生成HCl,半氯原子生成氯代烃,若四种有机取代产物的物质的量之比为 n(CH3Cl)∶n(CH2Cl2)∶n(CHCl3)∶n(CCl4)=1∶1∶1∶1,则四种取代物的物质的量均为0.25mol,消耗氯气的物质的量为0.1mol+2×0.25mol+3×0.25mol+4×0.25mol=2.5mol,故答案为:2.5mol。

【题目】已知:① X、Y、Z、W、R、Q为原子序数依次增大的短周期元素。X 是所有元素中原子半径最小的元素,Y是形成化合物种类最多的元素,W的最外层电子数是次外层电子数的3倍,Q与W同主族,Y、R原子的最外层电子数之和等于Z的最外层电子数。
②莱纳斯·卡尔·鲍林在1932年提出electronegativity作为元素原子在化合物某种性质的标度,electronegativity的大小可以判断元素金属性与非金属性强弱,下表列出部分短周期元素的Electronegativity的值。
元素 | X | Y | Z | W | R | Q |
electronegativity | 2.1 | 2.5 | 3.0 | 3.5 | 0.9 | 2.5 |
元素 | Mg | Li | Al | Cl | P | Be |
electronegativity | 1.2 | 1.0 | 1.5 | 3.0 | 2.1 | 1.5 |
请回答下列问题(涉及X、Y、Z、W、R、Q时,用元素符号表示):
(1)根据上表给出的数据,可知元素的electronegativity越大,__(填“金属性”或“非金属性”)越强。
(2)元素Q在周期表中的位置为_________。
(3)W、R、Q单核简单离子半径由大到小排列顺序为______。
(4)元素X、Z、W之间能形成多种10电子微粒,请写出反应物和产物均为X、Z、W之间形成的10电子微粒的一个离子方程式______________。
(5)一种由元素W、R组成的白色固体化合物,其电子式为_______________。
(6)试比较稳定性:X2W_____ X2Q;沸点:X2W_____ X2Q (填“<”或“>”)。
(7)元素 X、Y、Z、W、R、Q中的两种元素可形成原子个数比为1∶2的共价化合物,则这两种元素的原子序数之差不可能是_________。
A.2 B.4 C.5 D.7
【题目】NaClO是漂白液的有效成分,某研究小组探究NaClO溶液的性质,设计了下列实验:
装置图 | 试剂X | 实验现象 | |
| ① | 0.2molL-1盐酸 | 产生黄绿色气体 |
② | 0.2molL-1KI-淀粉溶液 | 溶液变蓝 | |
③ | 0.2molL-1FeSO4(H+)和KSCN混合溶液 | 溶液变红 | |
④ | 0.2molL-1AlCl3溶液 | 产生白色沉淀 | |
下列判断不正确的是
A.实验①中发生的反应:ClO-+Cl-+2H+=Cl2↑+H2O
B.实验②中发生的反应:ClO-+2I-+2H+=Cl-+I2+H2O
C.实验③中该条件下氧化性强弱:ClO->Fe3+
D.实验④中ClO-与Al3+相互促进水解