题目内容
【题目】某课外学习小组对日常生活中不可缺少的调味品M进行探究.已知C可在D中燃烧发出苍白色火焰.M与其他物质的转化关系如图所示(部分产物已略去):

(1)写出F的电子式 .
(2)若A是一种常见的酸性氧化物,且可用于制造玻璃,E溶液与F溶液反应可以制备一种胶体,则E溶液的俗称是___________
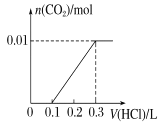
(3)若A是CO2气体,A与B溶液能够反应,反应后所得的溶液再与盐酸反应,如图所示,则A与B溶液反应后溶液中的溶质化学式为 .
(4)若A是一种常见金属单质,且A与B溶液能够反应,则将过量的F溶液逐滴加入E溶液,边加边振荡,所看到的实验现象是 .
(5)若A是一种化肥.实验室可用A和B反应制取气体E,E与F、E与D相遇均冒白烟,且利用E 与D的反应检验输送D的管道是否泄露,写出E与D反应的化学方程式是 .

(6)若A是一种溶液,只可能含有H+、NH4+、Mg2+、Fe3+、Al3+、CO32﹣、SO42﹣中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图.所示,由此可知,该溶液中肯定含有的离子及其浓度之比为 .
【答案】(1)![]() ;(2)水玻璃;
;(2)水玻璃;
(3)NaHCO3、Na2CO3;
(4)液中逐渐有白色絮状沉淀生成,且不断地增加,随后沉淀逐渐溶解最终消失;
(5)3Cl2+8NH3=N2+6NH4Cl;
(6)c(H+):c(Al3+):c(NH4+):c(SO42-)=1:1:2:3
【解析】
试题分析:(1)C在D中燃烧发出苍白色火焰,C为H2,D为Cl2,F为HCl,其电子式为:![]() ;(2)根据上述分析,电解饱和食盐水,得出B为氢氧化钠溶液,A是酸性氧化物,用于制造玻璃,则A为SiO2,E为Na2SiO3,其水溶液俗称水玻璃;(3)CO2和NaOH反应溶质可能为:NaOH、Na2CO3,Na2CO3,Na2CO3、NaHCO3,NaHCO3,从产生气体到气体最大消耗盐酸的体积大于0.1,说明溶质为Na2CO3和NaHCO3;(4)能和氢氧化钠溶液反应的金属单质为Al,2Al+2OH-+2H2O=2AlO2-+3H2↑,发生的反应是AlO2-+H++H2O=Al(OH)3↓,Al(OH)3+3H+=Al3++3H2O,出现现象是先有白色胶状沉淀,然后沉淀消失;(5)A是一种化肥,且与B反应产生气体,则A为铵盐,E为NH3,利用NH3的还原性和Cl2的氧化性,发生氧化还原反应,反应方程式为3Cl2+8NH3-N2+6NH4Cl;(6)开始没有沉淀产生,说明溶液中有H+,发生H++OH-=H2O,根据离子共存,溶液中没有CO32-,随着沉淀量增多,到达某一时刻,沉淀不再改变,说明溶液中有MH4+,发生NH4++OH-=NH3·H2O,然后沉淀量减少直至消失,说明含有Al3+,电荷守恒,溶液中含有SO42-,因此c(H+):c(Al3+):c(NH4+):c(SO42-)=1:1:2:3。
;(2)根据上述分析,电解饱和食盐水,得出B为氢氧化钠溶液,A是酸性氧化物,用于制造玻璃,则A为SiO2,E为Na2SiO3,其水溶液俗称水玻璃;(3)CO2和NaOH反应溶质可能为:NaOH、Na2CO3,Na2CO3,Na2CO3、NaHCO3,NaHCO3,从产生气体到气体最大消耗盐酸的体积大于0.1,说明溶质为Na2CO3和NaHCO3;(4)能和氢氧化钠溶液反应的金属单质为Al,2Al+2OH-+2H2O=2AlO2-+3H2↑,发生的反应是AlO2-+H++H2O=Al(OH)3↓,Al(OH)3+3H+=Al3++3H2O,出现现象是先有白色胶状沉淀,然后沉淀消失;(5)A是一种化肥,且与B反应产生气体,则A为铵盐,E为NH3,利用NH3的还原性和Cl2的氧化性,发生氧化还原反应,反应方程式为3Cl2+8NH3-N2+6NH4Cl;(6)开始没有沉淀产生,说明溶液中有H+,发生H++OH-=H2O,根据离子共存,溶液中没有CO32-,随着沉淀量增多,到达某一时刻,沉淀不再改变,说明溶液中有MH4+,发生NH4++OH-=NH3·H2O,然后沉淀量减少直至消失,说明含有Al3+,电荷守恒,溶液中含有SO42-,因此c(H+):c(Al3+):c(NH4+):c(SO42-)=1:1:2:3。

 阅读快车系列答案
阅读快车系列答案