��Ŀ����
����Ŀ���������һ����Ҫ�ķǽ������ϣ��Ʊ��������Ҫ�������£�
����������̿��ԭ���������Ƶôֹ裻
���ֹ������HCl���巴Ӧ�Ƶ�SiHCl3��Si��3HCl![]() SiHCl3��H2��
SiHCl3��H2��
��SiHCl3�����H2��1000��1100 ����Ӧ�Ƶô��衣
��֪��SiHCl3����H2Oǿ�ҷ�Ӧ���ڿ���������ȼ��
��ش��������⣺
��1���������Ʊ��ֹ�Ļ�ѧ����ʽΪ_____________________��
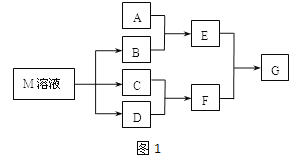
��2����SiHCl3�����H2��Ӧ�Ʊ������װ������(��Դ���г�װ����ȥ):
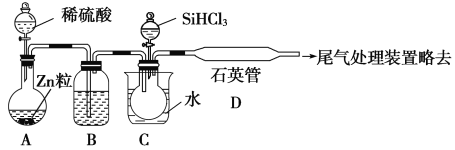
��װ��B�е��Լ���________��װ��C�е���ƿ��Ҫ���ȣ���Ŀ����_________________��
����Ӧһ��ʱ���װ��D�й۲쵽��������________________��װ��D�з�����Ӧ�Ļ�ѧ����ʽΪ__________________________��
��Ϊ��֤�Ʊ�����ʵ��ijɹ��������Ĺؼ��Ǽ��ʵ��װ�õ������ԣ����ƺ÷�Ӧ�¶��Լ�__________________________��
��SiHCl3�ĵ���ʽΪ________��SiHCl3��H2O��Ӧ�Ļ�ѧ����ʽΪ��_________________��
���𰸡���1��SiO2��2C![]() Si��2CO����
Si��2CO����
��2����Ũ���ʹ������ƿ�е�SiHCl3��������ʯӢ�ܷ�Ӧ��
���лҺ�ɫ�����������ɣ�SiHCl3��H2![]() Si��3HCl��
Si��3HCl��
���ž�װ���еĿ�����
��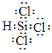 ��SiHCl3��3H2O=H2SiO3����3HCl+H2����SiHCl3��4H2O=H4SiO4����3HCl+H2����
��SiHCl3��3H2O=H2SiO3����3HCl+H2����SiHCl3��4H2O=H4SiO4����3HCl+H2����
��������
�����������1���ֹ��Ʊ�����C��SiO2��Ӧ�Ʊ�����Ӧ����ʽΪ��SiO2��2C![]() Si��2CO������2����SiHCl3��ˮ����ǿ�ҷ�Ӧ����˱���ˮ���룬���B��ʢ��Ũ���ᣬ����H2�е�ˮ������������ƿ�е�SiHCl3��������ʯӢ�ܷ�Ӧ����SiHCl3��H2
Si��2CO������2����SiHCl3��ˮ����ǿ�ҷ�Ӧ����˱���ˮ���룬���B��ʢ��Ũ���ᣬ����H2�е�ˮ������������ƿ�е�SiHCl3��������ʯӢ�ܷ�Ӧ����SiHCl3��H2 ![]() Si��3HCl���лҺ�ɫ�����������ɣ��������ǿ�ȼ�����壬�����������������ը�����Ҫ�ž�װ�õĿ��������ο�SiCl4�Ľṹ��SiHCl3�ĵ���ʽΪ��
Si��3HCl���лҺ�ɫ�����������ɣ��������ǿ�ȼ�����壬�����������������ը�����Ҫ�ž�װ�õĿ��������ο�SiCl4�Ľṹ��SiHCl3�ĵ���ʽΪ��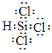 ����ˮ���ҷ�Ӧ���ڿ���������ȼ��˵��������ȼ�����壬SiHCl3��3H2O = H2SiO3����3HCl + H2����
����ˮ���ҷ�Ӧ���ڿ���������ȼ��˵��������ȼ�����壬SiHCl3��3H2O = H2SiO3����3HCl + H2����