��Ŀ����
����Ŀ������ѧ�����ʽṹ������������ͼ��Ԫ�����ڱ���һ���֡���֪R�ĺ˵����С��36����̬�⻯��е㣺MHn>YHn��
��1����������Ԫ�ص�һ������������ ����Ԫ�ط��ţ���Y������⻯����ӵĿռ乹��Ϊ ����̬Rԭ������ ��δ�ɶԵ��ӡ�
��2��Y������������۵��M������������۵�ͣ�ԭ���� ��YZ�����Ҽ���м���������Ϊ ��
��3��YO32����Yԭ�ӵ��ӻ���ʽ�� ��д��һ����YO32����Ϊ�ȵ����������� ���û�ѧ���ű�ʾ����
��4��Z��һ�ֳ����⻯����������ͭ��Ӧ�����������ýṹ��ʽ��ʾ��������е������ӣ� ��
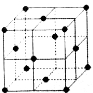
��5����ͼΪij�������ʵ��������������ṹʾ��ͼ���þ�������λ���� ����ô˾�����ܶ�Ϊ2.7g.cm��3�������ı߳�Ϊ0.405nm����˽���ԭ�ӵ����ԭ������Ϊ �����������������
���𰸡���1��N��1�֣��������壨1�֣�2��1�֣�
��2��Y������������Ƿ��Ӿ���,M�������������ԭ�Ӿ��� 1�U2��2�֣�
��3��sp2��2�֣� NO3-����SO32- ��SiO32-��BF3������1�֣�
��4�� 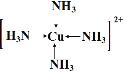 ����С���߲��۷֣���2�֣���5��12��1�֣� 27��2�֣�
����С���߲��۷֣���2�֣���5��12��1�֣� 27��2�֣�
��������
���������R�ĺ˵����С��36����Ԫ�������ڱ������λ�ã���֪X��Y��Z���ڵڶ����ڣ�M���ڵ������ڣ�R���ڵ������ڣ���̬�⻯��е㣺MHn��YHn���⻯��YHn����֮��û�������HԪ����AlԪ��֮�䲻���γ���̬�⻯���YΪCԪ�ء�MΪSi��RΪGe��XΪB��ZΪNԪ�ء�
��1��ͬ�������϶��µ�һ�����ܼ�С��ͬ������ԭ����������Ԫ�ص�һ����������Ԫ��2p�ܼ�Ϊ�����ȶ�״̬����һ�����ܸ���ͬ��������Ԫ�صģ���������Ԫ�ص�һ������������NԪ�أ�Y������⻯��ΪCH4�����ӵĿռ乹��Ϊ�������塣��̬Rԭ����Χ�����Ų�ʽΪ4s24p2�� 2��δ�ɶԵ��ӣ�
��2��Y�����������Ϊ���Ӿ��壬M�����������Ϊԭ�Ӿ��壬��Y������������۵��M������������۵�ͣ�CN-�뵪�����ӻ�Ϊ�ȵ����壬CN-��Cԭ����Nԭ��֮���γ�3�Թ��õ��Ӷԣ�����������������Ŀ��Ϊ1��2��
��3��CO32-��Cԭ�ӹµ��Ӷ���=(4+22��3)/2=0���۲���Ӷ���=3+0=3��Cԭ�ӵ��ӻ���ʽ��sp2��һ����CO32-��Ϊ�ȵ����������Ϊ NO3-����SO32-��SiO32-��BF3������
��4��Z��һ�ֳ����⻯����������ͭ��Ӧ����������������е�������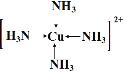 ��
��
��5���Զ���ԭ���о�����֮���ڵ�ԭ�Ӵ������ģ�ÿ������Ϊ8���������ã�ÿ������Ϊ2���������ã��þ�������λ����3��8/2=12��������ԭ����ĿΪ8��1/8+6��1/2 =4������������ԭ������ΪM����4��M/6.02��1023g=2.7g/cm3����0.405��10-7cm��3�����M=27.

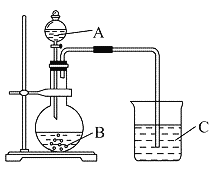
����Ŀ������ȱ�ʾ����ʵ����ǿ��������ȵĶ��壺
�������ѵ���ĵ���ʷ���������Һ��ԭ�е���ʵ��ܷ���������100%��
��֪25��ʱ���������������ĵ��������ҺŨ�Ⱦ�Ϊ0.1 mol��L��1�����±���
��� | ���������� | ����Ȧ� |
A | ������Һ����һ����ȫ���������ڶ���HSO4- | 10% |
B | ����������Һ��HSO4- | 29% |
C | ���CH3COOH | 1.33% |
D | ���HCl��H����Cl�� | 100% |
��1��25��ʱ��0.1 mol��L��1����������Һ�У�c��H������С�����˳���� �����������
��2��25��ʱ��0.1 mol��L��1������Һ��HSO4-�ĵ����С����ͬ�¶���0.1 mol��L��1����������Һ��HSO4-�ĵ���ȣ���ԭ���� ��
��3������ĵ���ƽ�ⳣ��K�ı���ʽ�� ������ĵ���ƽ�ⳣ��K�����Ȧ��Ĺ�ϵʽΪ��K= ���ú����Ĵ���ʽ��ʾ��