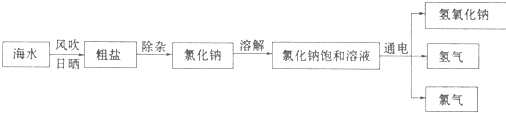
题目内容
19.氰化氢(HCN)主要应用于电镀业,其制备的化学方程式为:C2H4+NH3=HCN+CH4+H2,下列说法不正确的是( )| A. | C2H4分子中所有原子共平面 | B. | C2H4既作氧化剂,又作还原剂 | ||
| C. | HCN分子中既含σ键又含π键 | D. | 转移0.2mol电子,生成2.24L H2 |
分析 A、C2H4分子中C原子为sp2杂化,为平面三角形,据此判断;
B、根据C2H4在反应前后化合价的变化判断;
C、根据HCN分子结构为H-C≡N判断;
D、体积未标明标准状态,所以不能计算出2.24L;
解答 解:A、C2H4分子中C原子为sp2杂化,为平面三角形,所以所有原子共平面,故A正确;
B、C2H4在反应中1个C的化合价由-2升高到+2,1个C的化合价由-2降低到-4,所以既作氧化剂,又作还原剂,故B正确;
C、因为HCN分子结构为H-C≡N,所以既含σ键又含π键,故C正确;
D、该反应中只有C2H4在反应中1个C的化合价由-2升高到+2,所以1molC2H4转移4mol电子,则转移0.2mol电子,消耗0.05molC2H4,生成0.05molH2,未标明标准状态,所以不能计算出2.24L,故D错误;
故选D.
点评 本题考查氧化还原反应,难度较大,准确判断物质中元素的化合价是解答本题的关键,HCN中元素的化合价分析是学生解答中的难点.

练习册系列答案
 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
7.氮的固定是几百年来科学家一直研究的课题.
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值.
①分析数据可知:大气固氮反应属于吸热(填“吸热”或“放热”)反应.
②分析数据可知:人类不适合大规模模拟大气固氮的原因K值小,正向进行的程度小(或转化率低),不适合大规模生产.
③从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因从反应速率角度考虑,高温更好,但从催化剂活性等综合因素考虑选择500℃左右合适.
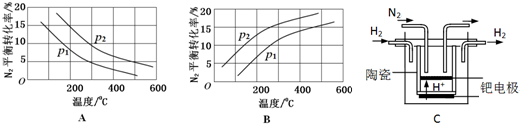
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,下图所示的图示中,正确的是A(填“A”或“B”);比较р1、р2的大小关系р2>р1.
(3)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电化学合成氨,提高了反应物的转化率,其实验简图如C所示,阴极的电极反应式是N2+6e-+6H+=2NH3.
(4)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O?4NH3(g)+3O2(g),则其反应热△H=+1530 kJ•mol-1.
(已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,2H2(g)+O2(g)?2H2O(l)△H=-571.6kJ•mol-1)
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值.
| 反应 | 大气固氮 N2(g)+O2(g)?2NO(g) | 工业固氮 N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
②分析数据可知:人类不适合大规模模拟大气固氮的原因K值小,正向进行的程度小(或转化率低),不适合大规模生产.
③从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因从反应速率角度考虑,高温更好,但从催化剂活性等综合因素考虑选择500℃左右合适.
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,下图所示的图示中,正确的是A(填“A”或“B”);比较р1、р2的大小关系р2>р1.
(3)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电化学合成氨,提高了反应物的转化率,其实验简图如C所示,阴极的电极反应式是N2+6e-+6H+=2NH3.
(4)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O?4NH3(g)+3O2(g),则其反应热△H=+1530 kJ•mol-1.
(已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,2H2(g)+O2(g)?2H2O(l)△H=-571.6kJ•mol-1)

14.如图所示的方案可以降低铁闸门的腐蚀速率.下列判断正确的是( )
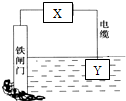

| A. | 若X为导线,Y可以是锌 | |
| B. | 若X为导线,铁闸门上的电极反应式为Fe-2e→Fe2+ | |
| C. | 若X为直流电源,铁闸门做负极 | |
| D. | 若X为直流电源,Y极上发生还原反应 |
11.短周期主族元素X、Y、W、Z的原子序数依次增大.其中X、Z同主族,Z的单质是一种良好的半导体材料,W3+与Y2-具有相同的核外电子数.下列叙述正确的是( )
| A. | Y2-的离子半径大于W3+的离子半径 | |
| B. | Y、Z形成的化合物为离子化合物 | |
| C. | Z的最高价氧化物对应的水化物的酸性比X的强 | |
| D. | X的气态简单氢化物的稳定性比Y的强 |
8.下列说法不正确的是( )
| A. | 生物炼铜比高温炼铜更清洁、成本更低 | |
| B. | 光分解水制氢气、植物秸秆制沼气、高粱制乙醇都涉及到生物质能的利用 | |
| C. | 用福尔马林灭活埃博拉病毒是利用了蛋白质变性原理 | |
| D. | 扫描隧道显微技术、超分辨率荧光显微技术等技术的发展促进了人类对物质微观结构的探索,使科学研究迈入更高水平层次 |
 某研究人员应用如图所表示的方法研究物质的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸气.请完成下列问题:
某研究人员应用如图所表示的方法研究物质的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸气.请完成下列问题: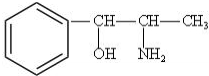 构简式如右图所示,其合成路线如下:A$→_{①}^{Cl_{2}}$B$→_{②}^{NaOH溶液/△}$C$→_{③}^{Cu/△}$D$→_{④}^{E}$F$→_{⑤}^{Fe、HCl}$PPA,其中A~F分别代表一种有机化合物,合成路线中部分产物及反应条件已略去.已知:
构简式如右图所示,其合成路线如下:A$→_{①}^{Cl_{2}}$B$→_{②}^{NaOH溶液/△}$C$→_{③}^{Cu/△}$D$→_{④}^{E}$F$→_{⑤}^{Fe、HCl}$PPA,其中A~F分别代表一种有机化合物,合成路线中部分产物及反应条件已略去.已知: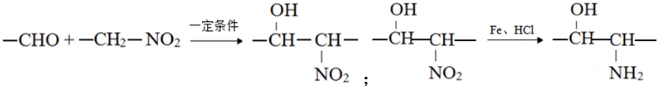
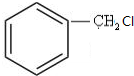 +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$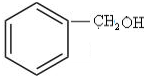 +NaCl.
+NaCl.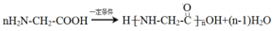 .
.