题目内容
11.短周期主族元素X、Y、W、Z的原子序数依次增大.其中X、Z同主族,Z的单质是一种良好的半导体材料,W3+与Y2-具有相同的核外电子数.下列叙述正确的是( )| A. | Y2-的离子半径大于W3+的离子半径 | |
| B. | Y、Z形成的化合物为离子化合物 | |
| C. | Z的最高价氧化物对应的水化物的酸性比X的强 | |
| D. | X的气态简单氢化物的稳定性比Y的强 |
分析 短周期主族元素X、Y、W、Z的原子序数依次增大,其中X、Z同主族,Z的单质是一种良好的半导体材料,则Z为Si、X为碳;
W3+与Y2-具有相同的核外电子数,W原子序数大于X而小于Z,则W为Al,Y为O元素,据此解答.
解答 解:短周期主族元素X、Y、W、Z的原子序数依次增大,其中X、Z同主族,Z的单质是一种良好的半导体材料,则Z为Si、X为碳;
W3+与Y2-具有相同的核外电子数,W原子序数大于X而小于Z,则W为Al,Y为O元素,
A.电子层结构相同,核电荷数越大离子半径越小,故离子半径Y2->W3+,故A正确;
B.Y、Z形成的化合物为二氧化硅,属于共价化合物,故B错误;
C.非金属性C>Si,故碳酸的酸性强于硅酸,故C错误;
D.非金属性C<O,故氢化物稳定性CH4<H2O,故D错误,
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意对元素周期律的理解掌握,有利于基础知识的巩固.

练习册系列答案
相关题目
1.已知:NO2(g)+SO2(g)一定条件_SO3(g)+NO(g),现将体积之比为1:2的NO2和SO2的混合气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是( )
| A. | 体系压强保持不变 | B. | 混合气体颜色保持不变 | ||
| C. | SO3与NO的体积比保持不变 | D. | 每消耗1molSO2,同时生成1molNO |
2.下列归类中,正确的是( )
| A. | Fe、Si--主族元素 | B. | Na2O2--碱性氧化物 | ||
| C. | 阿司匹林--抗酸药 | D. | 醋--调味剂和防腐剂 |
19.氰化氢(HCN)主要应用于电镀业,其制备的化学方程式为:C2H4+NH3=HCN+CH4+H2,下列说法不正确的是( )
| A. | C2H4分子中所有原子共平面 | B. | C2H4既作氧化剂,又作还原剂 | ||
| C. | HCN分子中既含σ键又含π键 | D. | 转移0.2mol电子,生成2.24L H2 |
6.下列化学用语书写正确的是( )
| A. | 纯碱溶液呈碱性的原因是:CO32-+2H2O?H2CO3+2OH- | |
| B. | 电解MgCl2水溶液的离子方程式:2Cl-+2 H2O 通电_H2↑+Cl2↑+2OH- | |
| C. | 质量数之和是质子数之和两倍的水分子符号可能是:D216O | |
| D. | 固体酒精是餐桌上常用的燃料,已知酒精的标准燃烧热是-1366.8kJ•mol-1,则表示酒精标准燃烧热的热化学方式式为: C2H5OH(s)+3O2(g)=2CO2(g)+2 H2O(l)△H=-1366.8kJ•mol-1 |
3.下列实验操作不正确或不能达到目的是( )
| A. | 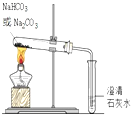 鉴别碳酸钠和碳酸氢钠 | B. | 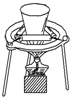 钠的燃烧 | ||
| C. | 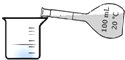 量取100.00mL溶液 | D. | 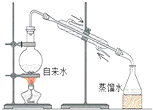 实验室制取蒸馏水 |
20.化学与人类生活、社会可持续发展密切相关.下列有关说法不正确的是( )
| A. | “静电除尘”、“汽车尾气的催化净化”都有利于提高空气的质量 | |
| B. | 减少化石燃料的使用,有利于降低空气中PM2.5的含量 | |
| C. | 石油的分馏是获得芳香烃的主要途径 | |
| D. | 医用酒精是用淀粉类植物发酵经蒸馏、加工制成,浓度通常是75% |
