题目内容
9.海洋是一个巨大的资源宝库,我们可以从海水中提取氯化钠,并以氯化钠和冰为原料制得氢氧化钠、氢气和氯气(C12).其制取的主要工艺流程如下: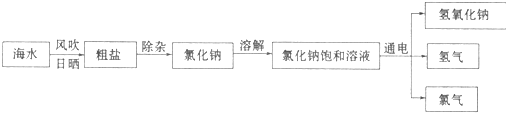
(1)利用风吹日晒可以从海水中提取粗盐,该过程主要发生物理变化(选填:“物理”或“化学”).
(2)要除去食盐水中混有少量的泥沙,你选择的操作方法是过滤
(3)请你写出氯化钠在生活中的一种用途作调味品
(4)氯化钠饱和溶液在通电条件下发生反应的化学方程式是2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.
分析 海水通过日晒蒸发浓缩得到粗盐,粗盐提纯得到精盐,溶解后制成饱和溶液,电解得到氢氧化钠、氯气和氢气;
(1)海水晒盐利用的是氯化钠溶解度随温度变化不大,蒸发溶剂的方法得到NaCl;
(2)固体和液体分离方法为过滤;
(3)氯化钠是常见的调味品;
(4)电解饱和食盐水生成氢氧化钠、氯气和氢气.
解答 解:海水通过日晒蒸发浓缩得到粗盐,粗盐提纯得到精盐,溶解后制成饱和溶液,电解得到氢氧化钠、氯气和氢气;
(1)海水晒盐利用的是氯化钠溶解度随温度变化不大,蒸发溶剂后析出氯化钠晶体,属于物理变化,故答案为:物理;
(2)泥沙不溶于水,则泥沙与食盐水的分离方法为过滤,故答案为:过滤;
(3)氯化钠是常见的调味品配制生理盐水或作融雪剂,故答案为:调味品;
(4)电解饱和食盐水生成氢氧化钠、氯气和氢气反应的化学方程式为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,故答案为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.
点评 本题考查了海水提取食盐及其氯碱工业的原理和实验过程分析判断,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
19.氰化氢(HCN)主要应用于电镀业,其制备的化学方程式为:C2H4+NH3=HCN+CH4+H2,下列说法不正确的是( )
| A. | C2H4分子中所有原子共平面 | B. | C2H4既作氧化剂,又作还原剂 | ||
| C. | HCN分子中既含σ键又含π键 | D. | 转移0.2mol电子,生成2.24L H2 |
20.化学与人类生活、社会可持续发展密切相关.下列有关说法不正确的是( )
| A. | “静电除尘”、“汽车尾气的催化净化”都有利于提高空气的质量 | |
| B. | 减少化石燃料的使用,有利于降低空气中PM2.5的含量 | |
| C. | 石油的分馏是获得芳香烃的主要途径 | |
| D. | 医用酒精是用淀粉类植物发酵经蒸馏、加工制成,浓度通常是75% |
17.化学现象中有许多“相等”,下列有关“相等”的说法,错误的是( )
| A. | 原子中核内质子数和核外电子数一定相等 | |
| B. | 中和反应中参加反应的酸和碱质量一定相等 | |
| C. | 溶液稀释前后溶质的质量一定相等 | |
| D. | 物质发生化学变化前后,质量总和一定相等 |
4.为了除去下表物质中的杂质(括号内为杂质),所选试剂(过量)及操作方法均正确的是( )
| 物质 | 选用试剂(过量) | 操作方法 | |
| A | Cu(CuO) | 氧气 | 通入氧气并加热 |
| B | CO2(HCl) | 氢氧化钠溶液 | 气体通过盛有氢氧化钠溶液的洗气瓶 |
| C | N2(O2) | 铜粉 | 气体通过炽热的铜粉 |
| D | KCl溶液(K2CO3) | 氯化钙溶液 | 加入氯化钙溶液充分反应后过滤 |
| A. | A | B. | B | C. | C | D. | D |
14.下列说法正确的是( )
| A. | 当今化学研究的方向是研究化学反应中原子的守恒关系 | |
| B. | 光导纤维由硅晶体制成,具有耐腐蚀、传输能力强等特点 | |
| C. | 煤在燃烧过程中要放出大量SO2,是引起光化学烟雾的“罪魁祸首” | |
| D. | 禽流感并不可怕,当加热到70℃以上或使用日常消毒剂都可使其病毒蛋白变性而致死 |
18.下列有机反应中,有一种反应类型与其他三种反应类型不同的是( )
| A. | CH3COOH+CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O | |
| B. | 2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O | |
| C. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | |
| D. |  +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$ +HBr +HBr |
 已知A、B、C、D、E、F都是周期表中前 四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素.A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子.
已知A、B、C、D、E、F都是周期表中前 四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素.A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子. ]-,其中心原子采用sp杂化.
]-,其中心原子采用sp杂化.