题目内容
14.如图所示的方案可以降低铁闸门的腐蚀速率.下列判断正确的是( )
| A. | 若X为导线,Y可以是锌 | |
| B. | 若X为导线,铁闸门上的电极反应式为Fe-2e→Fe2+ | |
| C. | 若X为直流电源,铁闸门做负极 | |
| D. | 若X为直流电源,Y极上发生还原反应 |
分析 作原电池的正极或电解池的阴极被保护,能降低铁闸门的腐蚀速率,据此分析.
解答 解:A.若X为导线,Y可以是锌,形成原电池,铁闸门作正极被保护,能降低铁闸门的腐蚀速率,故A正确;
B.若X为导线,铁闸门上的电极反应式为Fe-2e→Fe2+,则铁闸门作负极被腐蚀,所以不能降低铁闸门的腐蚀速率,故B错误;
C.若X为直流电源,铁闸门连接负极,作阴极,能降低铁闸门的腐蚀速率,故C错误;
D.若X为直流电源,铁闸门连接负极,作阴极,Y极为阳极,则Y极上发生氧化反应,故D错误.
故选A.
点评 本题考查了金属的腐蚀与防护,侧重于原电池原理和电解池原理的应用的考查,题目难度不大,注意把握原电池和电解池中电极的判断.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
5.下面说法中正确的是( )
| A. | 标有“ ”的包装材料可以用来包装食品 ”的包装材料可以用来包装食品 | |
| B. | 酒精消毒原理是将病毒彻底氧化 | |
| C. | GaN中的氮和镓均属于第IIIA族元素 | |
| D. | 麦芽糖的水解产物能发生银镜反应 |
2.下列归类中,正确的是( )
| A. | Fe、Si--主族元素 | B. | Na2O2--碱性氧化物 | ||
| C. | 阿司匹林--抗酸药 | D. | 醋--调味剂和防腐剂 |
9.下列有关说法正确的是( )
| A. | 已知:HI(g)═$\frac{1}{2}$H2(g)+$\frac{1}{2}$I2(s)△H=-26.5kJ/mol,由此可知1mol HI气体在密闭容器中充分分解后可以放出26.5kJ的热量 | |
| B. | 已知:2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol,则氢气的燃烧热为△H=-285.8kJ/mol | |
| C. | 肼(N2H4)是一种用于火箭或燃料电池的原料,已知2H2O(g)+O2(g)=2H2O2(l)△H=+108.3kJ/mol ①N2H4(l)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ/mol ②则有反应:N2H4(l)+2H2O2(l)=N2(g)+4H2O(l)△H=-642.3kJ/mol | |
| D. | 含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l)△H=-57.4kJ/mol |
19.氰化氢(HCN)主要应用于电镀业,其制备的化学方程式为:C2H4+NH3=HCN+CH4+H2,下列说法不正确的是( )
| A. | C2H4分子中所有原子共平面 | B. | C2H4既作氧化剂,又作还原剂 | ||
| C. | HCN分子中既含σ键又含π键 | D. | 转移0.2mol电子,生成2.24L H2 |
6.下列化学用语书写正确的是( )
| A. | 纯碱溶液呈碱性的原因是:CO32-+2H2O?H2CO3+2OH- | |
| B. | 电解MgCl2水溶液的离子方程式:2Cl-+2 H2O $\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH- | |
| C. | 质量数之和是质子数之和两倍的水分子符号可能是:D216O | |
| D. | 固体酒精是餐桌上常用的燃料,已知酒精的标准燃烧热是-1366.8kJ•mol-1,则表示酒精标准燃烧热的热化学方式式为: C2H5OH(s)+3O2(g)=2CO2(g)+2 H2O(l)△H=-1366.8kJ•mol-1 |
3.下列实验操作不正确或不能达到目的是( )
| A. |  鉴别碳酸钠和碳酸氢钠 | B. |  钠的燃烧 | ||
| C. | 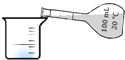 量取100.00mL溶液 | D. | 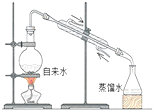 实验室制取蒸馏水 |
4.为了除去下表物质中的杂质(括号内为杂质),所选试剂(过量)及操作方法均正确的是( )
| 物质 | 选用试剂(过量) | 操作方法 | |
| A | Cu(CuO) | 氧气 | 通入氧气并加热 |
| B | CO2(HCl) | 氢氧化钠溶液 | 气体通过盛有氢氧化钠溶液的洗气瓶 |
| C | N2(O2) | 铜粉 | 气体通过炽热的铜粉 |
| D | KCl溶液(K2CO3) | 氯化钙溶液 | 加入氯化钙溶液充分反应后过滤 |
| A. | A | B. | B | C. | C | D. | D |