题目内容
【题目】AlCl3是一种催化剂,某校学习小组用下面装置制备少量AlCl3。已知:AlCl3遇到空气中的水蒸气时能剧烈反应生成Al(OH)3和HCl;AlCl3在180℃时升华。根据要求完成下列问题:
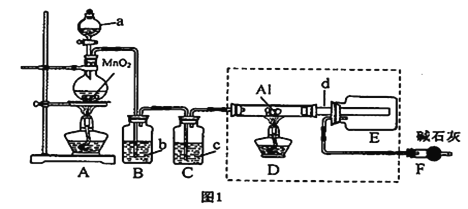
(1)A装置中反应的化学方程式为____________________________。
(2)试剂b为______________。
(3)所用d导管较粗的原因是______________;E装置的作用为______________。
(4)F装置的作用为______________。
(5)若图l中的D、E装置改为下面装置,D装置中的现象为_____________________;用离子方程式表示E中的现象变化____________________________。
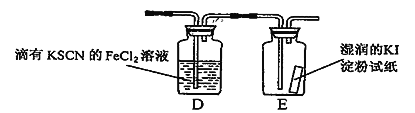
【答案】 ![]() 饱和食盐水 防止三氯化铝气体冷凝为固体而堵塞导管 冷凝、收集氯化铝 吸收氯气防止污染空气,防止空气中的水蒸气进入E装置 溶液变红色 Cl2+2I-= I2 + 2Cl-
饱和食盐水 防止三氯化铝气体冷凝为固体而堵塞导管 冷凝、收集氯化铝 吸收氯气防止污染空气,防止空气中的水蒸气进入E装置 溶液变红色 Cl2+2I-= I2 + 2Cl-
【解析】(1) 用二氧化锰与浓盐酸加热反应制备氯气,化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;正确答案:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;正确答案:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(2)生成的氯气中含有氯化氢,可用饱和食盐水除去氯气中的氯化氢,则试剂b为饱和食盐水;正确答案:饱和食盐水。
(3)由于氯化铝的熔沸点较低,因此所用d导管较粗,可以防止三氯化铝气体冷凝为固体而堵塞导管;E装置的作用为冷凝、收集三氯化铝;正确答案:防止三氯化铝气体冷凝为固体而堵塞导管;冷凝、收集氯化铝。
(4)氯气有毒,需要尾气处理,另外空气中含有水蒸气,因此F装置的作用为吸收氯气防止污染空气,防止空气中的水蒸气进入E装置导致三氯化铝水解;正确答案:吸收氯气防止污染空气,防止空气中的水蒸气进入E装置。
(5)氯气具有强氧化性,能把氯化亚铁氧化为氯化铁,Fe3+与SCN-反应生成Fe(SCN)3红色溶液,则D装置中的现象为溶液变红色;氯气还能把碘化钾氧化生成单质碘,碘遇淀粉显蓝色,反应的离子方程式为Cl2+2I-=I2+2Cl-;正确答案:溶液变红色; Cl2+2I-= I2 + 2Cl-。

【题目】为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应的措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.
(1)实验测得,5g甲醇(CH3OH,液态)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式: .
(2)已知化学键的键能为:
化学键 | H﹣H | N﹣H | N≡N |
键能/kJmol﹣1 | 436 | 391 | 945 |
又知反应N2(g)+3H2(g)2NH3(g)△H=a kJmol﹣1 . 试根据表中所列键能数据估算a的值为 .
(3)已知:C(s,石墨)+O2(g)═CO2(g)△H=﹣393kJmol﹣1
2H2(g)+O2(g)═2H2O(l)△H=﹣571.6kJmol﹣1
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=﹣2599kJmol﹣1
根据盖斯定律,计算 298K时C(s,石墨)和H2(g)反应生成1mol C2H2(g)的焓变为 .
【题目】下图是元素周期表的一部分,元素①~⑨在周期表中的位置如图所示(序号代表对应的元素)。
① | |||||||||||||||||
② | ③ | ④ | ⑤ | ||||||||||||||
⑥ | ⑦ | ⑧ | ⑨ | ||||||||||||||
…… | |||||||||||||||||
(1)④在周期表中位于第_____周期_____族。
(2)9种元素中原子半径最大的是______(填元素符号),非金属性最强的是______(填元素符号);
(3)最高价氧化物对应水化物的碱性⑥_____⑦(填“>”或“<”)。
(4)⑧的阴离子的结构示意图为______;③的简单氢化物与⑧的最高价氧化物对应水化物化合生成的盐的化学式为_______。