题目内容
【题目】如图为实验室制取和收集纯净干燥的氯气,并进行氯气性质探究的实验装置图:
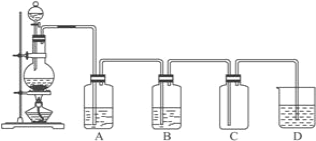
(1)反应前,在__________中装浓盐酸(填写仪器名称),__________中装MnO2(填写仪器名称)
(2)装置A中所装试剂是______,装置B中所装的试剂是_____________。
(3)装置D中所装试剂是______,发生反应的化学方程式为______________________。
(4)实验室备用的浓盐酸质量分数为36.5%,密度为1.19 g·cm-3,为使用方便,请计算出该浓盐酸的物质的量浓度______________。
【答案】 分液漏斗 圆底烧瓶 饱和食盐水 浓硫酸 NaOH溶液 Cl2+2NaOH==NaCl+NaClO+H2O 11.9mol/L
【解析】本题考查实验方案设计与评价,(1)此反应是固体与液体反应制备气体,浓盐酸应盛放在分液漏斗中,圆底烧瓶盛装MnO2;(2)实验目的是制取和收集纯净的氯气,以及验证氯气的性质,MnO2与浓盐酸反应制取的氯气中混有HCl和水蒸气,装置A的作用是除去HCl,即装置A中盛放的是饱和食盐水,装置B的作用是除去氯气中水蒸气,装置B盛放的是浓硫酸;(3)装置C是收集氯气,氯气有毒,必须尾气处理,装置D的作用是除去过量的氯气,即装置D中盛放NaOH溶液;发生的化学反应方程式为Cl2+2NaOH=NaCl+NaClO+H2O;(4)根据c=1000ρω%/M=1000×1.19×36.5%/36.5mol·L-1=11.9mol·L-1。

练习册系列答案
相关题目