题目内容
【题目】某实验小组同学进行如图所示实验,以检验化学反应中的能量变化。
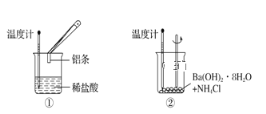
(1)实验发现,装置②中反应后溶液的温度________。
a.升高 b.降低 c.不变
(2)装置①中发生的反应,反应物的总能量比生成物的总能量_________。
a.高 b.低 c.相等
(3)已知断裂1 mol共价键需要吸收的能量分别为H-H:436kJ,I-I:151 kJ,H-I:299kJ。则反应H2+I2=2HI的能量变化为_______。
a.吸热 b.放热 c.无能量变化
(4)碱金属单质在空气中燃烧的产物与碱金属的活泼性有关。若某同学做了锂单质在空气中燃烧的实验,他得到的产物应为_____。(填化学式)
【答案】b a b Li2O
【解析】
(1)氢氧化钡晶体与氯化铵晶体混合,是典型的吸热反应;
(2)金属与酸反应放热;
(3)断裂化学键吸热、形成化学键放热;
(4)锂的活泼性小于钠;
(1)氢氧化钡晶体与氯化铵晶体混合,是典型的吸热反应,所以装置②中反应后溶液的温度降低,选b;
(2)铝与盐酸是放热反应,所以反应物的总能量比生成物的总能量高,故选a;
(3)反应H2+I2=2HI断裂化学键吸收的能量为436kJ+151 kJ=587 kJ,形成化学键放出能量299kJ×2=598 kJ,放出的能量大于吸收的能量,所以反应放热,选b;
(4)钠在空气中燃烧生成Na2O2,锂的活泼性小于钠,所以锂单质在空气中燃烧的产物应为Li2O。

【题目】草酸钴可用于指示剂和催化剂的制备。用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO、SiO2等)制取CoC2O4·2H2O工艺流程如下:
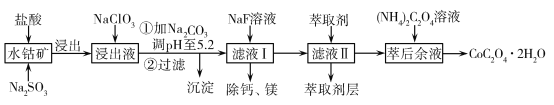
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②酸性条件下,ClO不会氧化Co2+,ClO转化为Cl-;③部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
(1)浸出过程中加入Na2SO3的主要目的是________。
(2)向浸出液中加入NaClO3的离子反应方程式:________。
(3)已知:常温下NH3·H2O![]() NH4++OH- Kb=1.8×10-5
NH4++OH- Kb=1.8×10-5
H2C2O4![]() H++HC2O4- Ka1=5.4×10-2 HC2O4-
H++HC2O4- Ka1=5.4×10-2 HC2O4-![]() H++C2O42- Ka2=5.4×10-5
H++C2O42- Ka2=5.4×10-5
则该流程中所用(NH4)2C2O4溶液的pH________7(填“>”或“<”或“=”)。
(4)加入(NH4)2C2O4 溶液后析出晶体,再过滤、洗涤,洗涤时可选用的试剂有:________。
A.蒸馏水 B.自来水
C.饱和的(NH4)2C2O4溶液 D.稀盐酸
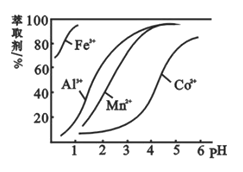
(5)萃取剂对金属离子的萃取率与pH的关系如图,萃取剂的作用是________;其使用的适宜pH范围是________。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5