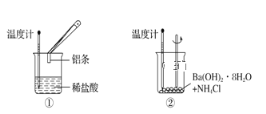
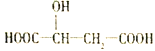题目内容
【题目】下列物质属于电解质的是( )
A.蔗糖B.铜C.NaOHD.SO2
【答案】C
【解析】
电解质是溶于水或熔融状态下能导电的化合物,其本质是在一定条件下自身能电离的化合物。
A. 蔗糖是溶于水和熔融状态下都不能导电的化合物,蔗糖属于非电解质,A选项不符合题意;
B. 铜是单质,既不是电解质,又不是非电解质,B选项不符合题意;
C. 氢氧化钠是溶于水或熔融状态下都能导电的化合物,氢氧化钠属于电解质,C选项符合题意;
D. 二氧化硫溶于水形成的溶液能导电,是由于二氧化硫与水反应生成了亚硫酸,亚硫酸能电离,从而使溶液能导电,而二氧化硫本身不能电离,所以二氧化硫属于非电解质,D选项不符合题意;
答案选C。

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案【题目】I.现有常温下pH=2的HCl溶液甲和pH=2的CH3COOH溶液乙,请根据下列操作回答问题:
(1)常温下0.1mol·L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据一定变小的是_____。
A.c(H+) B.![]() C.c(H+)·c(OH-)
C.c(H+)·c(OH-)
(2)取10mL的乙溶液,加入等体积的水,CH3COOH的电离平衡________(填“向左”“向右”或“不”)移动;另取10mL的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后溶液体积保持不变),待固体溶解后,溶液中![]() 的比值将________(填“增大”“减小”或“无法确定”)。
的比值将________(填“增大”“减小”或“无法确定”)。
(3)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗NaOH溶液体积的大小关系为V(甲)________(填“>”“<”或“=”)V(乙)。
(4)已知25℃时,下列酸的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=4.7×10-11 | 3.0×10-8 |
下列四种离子结合H+能力最强的是________。
A.HCO B.CO![]() C.ClO- D.CH3COO-
C.ClO- D.CH3COO-
写出下列反应的离子方程式:HClO+Na2CO3(少量):______________________
II.室温下,0.1 mol·L-l的KOH溶液滴10.00mL 0.10 mol·L-l H2C2O4 (二元弱酸)溶液,所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和)。请回答下列问题:
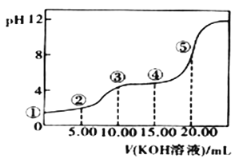
(5)点③所示溶液中所有离子的浓度由大到小的顺序为:________________________。点④所示溶液中:c(K+)+c(H2C2O4)+c(HC2O4)+c(C2O42)=________mol/L。