题目内容
【题目】草酸钴可用于指示剂和催化剂的制备。用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO、SiO2等)制取CoC2O4·2H2O工艺流程如下:
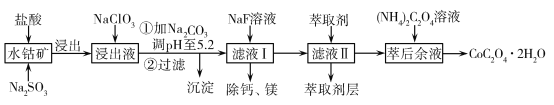
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②酸性条件下,ClO不会氧化Co2+,ClO转化为Cl-;③部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
(1)浸出过程中加入Na2SO3的主要目的是________。
(2)向浸出液中加入NaClO3的离子反应方程式:________。
(3)已知:常温下NH3·H2O![]() NH4++OH- Kb=1.8×10-5
NH4++OH- Kb=1.8×10-5
H2C2O4![]() H++HC2O4- Ka1=5.4×10-2 HC2O4-
H++HC2O4- Ka1=5.4×10-2 HC2O4-![]() H++C2O42- Ka2=5.4×10-5
H++C2O42- Ka2=5.4×10-5
则该流程中所用(NH4)2C2O4溶液的pH________7(填“>”或“<”或“=”)。
(4)加入(NH4)2C2O4 溶液后析出晶体,再过滤、洗涤,洗涤时可选用的试剂有:________。
A.蒸馏水 B.自来水
C.饱和的(NH4)2C2O4溶液 D.稀盐酸
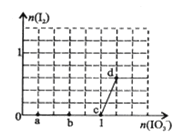
(5)萃取剂对金属离子的萃取率与pH的关系如图,萃取剂的作用是________;其使用的适宜pH范围是________。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
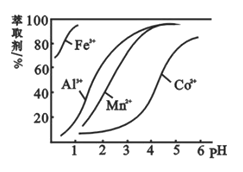
【答案】将Co3+、Fe3+还原为Co2+、Fe2+ ClO+6Fe2+ + 6H+=== Cl-+6Fe3++3H2O < A 除去溶液中的Mn2+ B
【解析】
含钴废料中加入盐酸和亚硫酸钠,可得CoCl2、AlCl3、FeCl2、MgCl2、CaCl2、MnCl2混合液;浸出液中加入NaClO3,可将FeCl2氧化为FeCl3,加入Na2CO3调溶液pH至5.2,由表格信息可知,AlCl3、FeCl3转化为Fe(OH)3、Al(OH)3沉淀而被除去;过滤后所得滤液I主要含有CoCl2、MgCl2、CaCl2、MnCl2,向溶液中加入NaF溶液,目的是除去钙、镁离子;过滤得到的滤液II中加入萃取剂除去溶液中的Mn2+,萃取后,萃取余液中加入草酸铵,过滤得到草酸钴晶体。
(1)亚硫酸钠具有还原性,能还原氧化性离子Fe3+、Co3+,所以浸出过程中加入Na2SO3的目的是将Fe3+、Co3+还原为Fe2+、Co2+。(2)NaClO3具有氧化性,能将浸出液中的Fe2+氧化成Fe3+,自身被还原生成氯离子,同时生成水,离子反应方程式为ClO3-+6Fe2++6H+=
6Fe3++Cl-+3H2O。(3)依据盐类水解可知,盐溶液的酸碱性取决于酸碱的强弱,谁强显谁性,由电离常数NH3H2ONH4++OH-Kb=1.8×10-5,HCO4-H++C2O42-Ka2=5.4×10-5可知,(NH4)2C2O4溶液中铵根离子水解大于草酸根离子水解,溶液呈酸性,即PH<7。(4)为洗涤晶体附着的离子,同时不引入新的杂质离子,过滤获得晶体洗涤时,可直接选用蒸馏水洗涤。(5)滤液中加入萃取剂的作用是除去锰离子;pH=2与pH=3时Co2+的萃取率变化不大,但pH=3时Mn的萃取率增大很多,而pH=5时,Co2+的萃取率比较大,损失严重,故pH=3时最佳。

 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案【题目】Ⅰ.控制变量法是化学实验的一种常用方法。下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:
序号 | 硫酸的体积/mL | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
1 | 50.0 | 2.0 | 薄片 | 25 | 100 | m1 |
2 | 50.0 | 2.0 | 颗粒 | 25 | 70 | m2 |
3 | 50.0 | 2.0 | 颗粒 | 35 | 35 | m3 |
4 | 50.0 | 2.0 | 粉末 | 25 | 45 | 5.0 |
5 | 50.0 | 6.0 | 粉末 | 35 | 30 | m5 |
6 | 50.0 | 8.0 | 粉末 | 25 | t6 | 16.1 |
7 | 50.0 | 10.0 | 粉末 | 25 | t7 | 16.1 |
(1)化学反应速率本质上是由物质的性质决定的,但外界条件也会影响反应速率的大小。本实验中实验2和实验3对比得出的结论是______________________________。
(2)我们最好选取实验________(填3个实验序号)研究锌的形状对反应速率的影响。
(3)若采用与实验1完全相同的条件,但向反应容器中滴加少量硫酸铜溶液,发现反应速率明显加快。原因是______________________________。
(4)利用表中数据,可以求得:硫酸的物质的量浓度是________mol/L。
Ⅱ.某温度时,在5 L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。请通过计算回答下列问题:
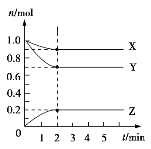
(5)反应开始至2 min,Y的平均反应速率______________________。
(6)分析有关数据,写出X、Y、Z的反应方程式_________________。