题目内容
18.在用锌、铜和稀H2SO4构成的原电池装置中,经过一段时间的工作后,下列说法正确的是( )| A. | 锌是正极,铜上有气泡产生 | |
| B. | 电流方向是从锌到铜 | |
| C. | 电解液的pH保持不变 | |
| D. | 当导线中有1mol电子通过时,铜片上析出1 g H2 |
分析 锌比铜活泼,形成原电池反应时,锌为负极,发生氧化反应,铜为正极,正极上氢离子得电子发生还原反应,电子从负极流向正极,以此解答.
解答 解:A、锌比铜活泼,应为原电池的负极,发生氧化反应,铜为正极,发生还原反应,则A错误;
B、电流从正极流向负极,则从铜片经导线流向锌片,故B错误;
C、正极上氢离子得电子发生还原反应,则氢离子浓度减小,所以反应一段时间后,溶液的pH升高,故C错误;
D、铜为正极,发生还原反应即2H++2e-=H2↑,所以有1mol电子通过时,铜片上析出0.5×2=1gH2,故D正确.
故选D.
点评 本题考查原电池池知识,侧重于学生的分析能力和电化学知识的综合考查,注意把握电极方程式的书写,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.苹果酸的结构简式为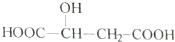 ,下列说法中不正确的是( )
,下列说法中不正确的是( )
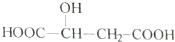 ,下列说法中不正确的是( )
,下列说法中不正确的是( )| A. | 苹果酸中能发生酯化反应的官能团有2种 | |
| B. | 1mol苹果酸可与2molNaOH发生中和反应 | |
| C. | 苹果酸可以发生消去反应,生成的有机物存在顺反异构体 | |
| D. |  与苹果酸互为同分异构体 与苹果酸互为同分异构体 |
13.某气态烃1mol和2mol氯化氢完全加成反应,所得产物还能和8molCl2发生取代反应,最后得到一种只含碳和氯两种元素的化合物,则原有气态烃可能为( )
| A. | CH≡CCH2CH2CH3 | B. | CH2CH2C≡CH | C. | CH2=CHCH3 | D. | CH≡CCH3 |
10.下列各组液体混合物,用分液漏斗能分开的是( )
| A. | 苯和硝基苯 | B. | 液溴和四氯化碳 | C. | 乙醛和水 | D. | 溴苯和水 |
7.如果a克氨气由b个原子构成,则在2a克硫化氢中含有的分子数为( )
| A. | 0.25b | B. | 0.5b | C. | 2b | D. | 4b |
8.人体内最重要的供能物质是( )
| A. | 葡萄糖 | B. | 纤维素 | C. | 油脂 | D. | 蛋白质 |
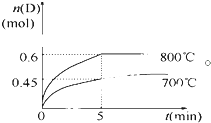 在容积为1L的密闭容器中,进行如下反应:A(g)+2B(g)?C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图.
在容积为1L的密闭容器中,进行如下反应:A(g)+2B(g)?C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图.