题目内容
【题目】有机物的反应往往伴随副反应发生,因此 需要分离提纯。有一种水果香精的合成步骤如下:
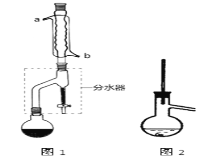
Ⅰ合成:
在干燥的圆底烧瓶中加入11.5 mL(9.3 g,0.125 mol)正丁醇、7.2 mL(7.5 g,0.125 mol)冰醋酸和3~4滴浓H2SO4,摇匀后,加几粒沸石,再按图1所示装置安装好。在分水器中预先加入5.00 mL水,其水面低于分水器回流支管下沿3~5 mm,然后用小火加热,反应大约40 min。
Ⅱ分离提纯:
① 将烧瓶中反应后的混合物冷却后与分水器中的酯层合并,转入分液漏斗,依次用10 mL水、10 mL 10% 碳酸钠溶液洗至中性,充分振荡后静置,分去水层。
② 将酯层倒入小锥形瓶中,加少量无水硫酸镁干燥。
③ 将乙酸正丁酯粗产品转入50 mL蒸馏烧瓶中,加几粒沸石进行常压蒸馏,收集产品。
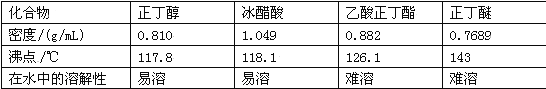
主要试剂及产物的物理常数如下:
制备过程中还可能有的副反应:
2CH3CH2CH2CH2OH![]() CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
(1)合成和分离过程中均使用沸石,其作用________________________ 。
(2)如图1整个装置可看作由分水器、圆底烧瓶和冷凝管组成,其中冷水应从______(填a或b)管口通入。
(3)在操作步骤②后(即酯层用无水硫酸镁干燥后),应先_______(填实验操作名称),然后将乙酸正丁酯粗产品转入蒸馏烧瓶中,如果蒸馏装置如图2所示,则收集到的产品中可能混有___________杂质。
(4)步骤③的常压蒸馏,需控制一定的温度,你认为在______中加热比较合适(请从下列选项中选择)。
A.水 B.甘油(沸点290℃)
C.沙子 D.石蜡油(沸点200~300℃)
(5)如何根据装置中的实验现象判断该合成反应达到了终点_______________ 。
(6)反应结束后,若放出的水为6.98 mL(水的密度为1g/mL),则正丁醇的利用率约为__________。
【答案】
(1)是防止液体加热时发生暴沸;
(2)b;
(3)过滤;正丁醚;
(4)BD;
(5)分水器中水面不再升高;
(6)88%。
【解析】
试题分析:(1)合成和分离过程中均使用沸石,其作用是防止液体加热时发生暴沸,即防止液体加热时发生暴沸;(2)冷凝管采取逆流原理通入冷凝水,其中冷水应从b管口通入,从a管中流出,有利于冷却,
故答案为:b;(3)酯层用无水硫酸镁干燥后,应过滤除去干燥剂;正丁醇和乙酸易溶于水,在用水洗、10%碳酸钠溶液洗时,已经被除去,正丁醚与乙酸丁酯互溶,水洗和10%碳酸钠溶液洗时不能除去,所以蒸馏时会有少量挥发进入乙酸丁酯,则乙酸正丁酯的杂质为正丁醚,(4)乙酸正丁酯的沸点是126.1℃,选择沸点稍高的液体加热,所以可以在甘油和石蜡油中加热,水的沸点为100℃,加热温度太低,用砂子加热温度太高不易控制;(5)合成反应中生成水,分离回流到分水器中,分水器中水面不再升高说明反应结束;(6)反应结束后,若放出的水为6.98mL(水的密度为1gmL-1),则反应生成的水为6.98mL-5.00mL=1.98mL,即1.98g,设参加反应的正丁醇为x,
CH3COOH+CH3CH2CH2CH2OH![]() CH3COOCH2CH2CH2CH3+H2O
CH3COOCH2CH2CH2CH3+H2O
74 18
x 1.98g
则x=(74×1.98g)÷18g=8.14g,所以正丁醇的利用率为(8.14g÷9.3g)×100%=88%。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案