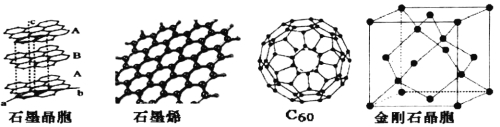
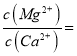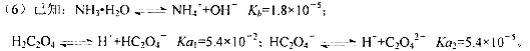题目内容
【题目】甲元素的原子序数是19,乙元素原子核外有两个电子层,最外电子层上有6个电子;丙是元素周期表第ⅠA族中金属性最弱的碱金属元素。由此推断:
(1)甲元素在周期表中位置是________;
(2)甲的单质与水反应的离子方程式为____;乙单质与丙单质反应的化学方程式为_________。
(3)甲元素和丙元素的最高价氧化物对应水合物的碱性较强的是_______________(填化学式)。
【答案】(1)第四周期第ⅠA族 (2)2K+2H2O=2K++2OH-+H2↑(3分)
4Li+O2![]() 2Li2O (3)KOH
2Li2O (3)KOH
【解析】试题分析:甲元素的原子序数是19,则甲是K;乙元素原子核外有两个电子层,最外电子层上有6个电子,因此乙的原子序数是8,即乙是O;丙是元素周期表第ⅠA族中金属性最弱的碱金属元素,则丙是Li。
(1)钾元素在周期表中位置是第四周期第ⅠA族;
(2)甲的单质与水反应的离子方程式为2K+2H2O=2K++2OH-+H2↑;乙单质与丙单质反应的化学方程式为4Li+O2![]() 2Li2O。
2Li2O。
(3)金属性是K>Li,金属性越强,最高价氧化物对应水化物的碱性越强,则甲元素和丙元素的最高价氧化物对应水合物的碱性较强的是KOH。

练习册系列答案
相关题目