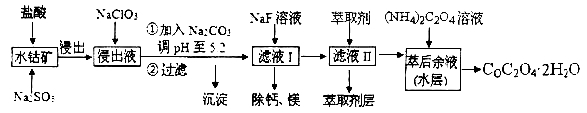
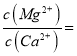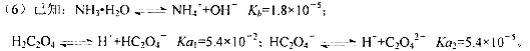题目内容
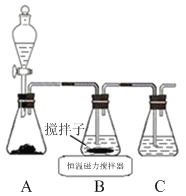
【题目】实验室用下图所示装置制备AlC13溶液,并用AlC13溶液溶解一定量的CaCO3形成溶液,再用氨水沉淀,然后锻烧沉淀制备新型的超导材料和发光材料七铝十二钙 (12CaO·7Al2O3)。已知A1C13易水解,易升华。
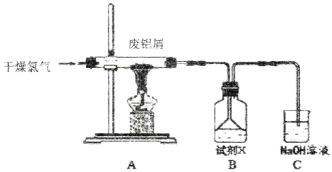
(1)①实验室用氯酸钾和浓盐酸制备氯气,其离子方程式为____________;
②C装置的作用____________;
(2)氯气与废铝屑反应生成的AlC13蒸气溶解在B中,B中盛放的试剂X是____________;为了防止AlC13蒸气凝华堵塞导管,实验中可采取的措施是____________(写出一点)。
(3)B装置中的AlC13溶液溶解CaCO3时,AlC13溶液和碳酸钙粉末的混合方式为____________;
(4)实验要控制碳酸钙和AlC13的量,要求n(CaCO3): n(A1C13)> 12:14,其原因是____________;
(5)以工业碳酸钙(含有少量A12O3、Fe2O3杂质)生产二水合氯化钙(CaC12·2H2O)的方法为:将工业碳酸钙溶于盐酸,____________。
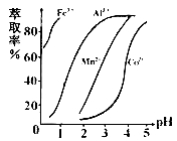
已知:几种离子生成氢氧化物沉淀pH(开始沉淀的pH按金属离子浓度为1.0mol/L计算)

(实验中需用到的试剂和仪器有:盐酸,氢氧化钙,冰水,pH计)。
【答案】
(1)①ClO3-+5Cl-+6H+=3Cl2+3H2O;②吸收氯气,防止污染空气
(2)盐酸;加粗导管、缩短导管长度、加热导管、通入氮气等
(3)碳酸钙粉末慢慢加入到AlCl3溶液中
(4)氢氧化钙微溶于水,造成损失
(5)向溶液中加入氢氧化钙,搅拌,用pH计调节溶液的pH≤4.7,过滤,向滤液中加盐酸酸化,蒸发浓缩,冷却结晶,过滤,冰水洗涤,干燥。
【解析】
试题分析:(1)①实验室用氯酸钾和浓盐酸制备氯气,离子方程式为ClO3-+5Cl-+6H+=3Cl2+3H2O,故答案为:ClO3-+5Cl-+6H+=3Cl2+3H2O;
②氯气有毒会污染空气,C装置可以吸收氯气,防止污染空气,故答案为:吸收氯气,防止污染空气;
(2)AlC13水解会使得溶液浑浊,因此B中盛放的试剂X是盐酸,为了防止AlC13蒸气凝华堵塞导管,实验中可采取的措施有加粗导管、缩短导管长度、加热导管、通入氮气等,故答案为:盐酸;加粗导管、缩短导管长度、加热导管、通入氮气等;
(3) AlC13溶液水解显酸性,可以溶解CaCO3时,实验时AlC13溶液和碳酸钙粉末的混合方式是碳酸钙粉末慢慢加入到AlCl3溶液中,故答案为:碳酸钙粉末慢慢加入到AlCl3溶液中;
(4)氢氧化钙微溶于水,容易造成损失,因此实验要控制碳酸钙和AlC13的量,要求n(CaCO3): n(A1C13)> 12:14,故答案为:氢氧化钙微溶于水,造成损失;
(5)根据离子的沉淀相关的pH可知,为了生成二水合氯化钙(CaC12·2H2O),需要将铁离子和铝离子除去,可以通过调节溶液的pH,使之转化为沉淀,具体操作为:将工业碳酸钙溶于盐酸,向溶液中加入氢氧化钙,搅拌,用pH计调节溶液的pH≤4.7,过滤,向滤液中加盐酸酸化,蒸发浓缩,冷却结晶,过滤,冰水洗涤,干燥。故答案为:向溶液中加入氢氧化钙,搅拌,用pH计调节溶液的pH≤4.7,过滤,向滤液中加盐酸酸化,蒸发浓缩,冷却结晶,过滤,冰水洗涤,干燥。

 阅读快车系列答案
阅读快车系列答案