题目内容
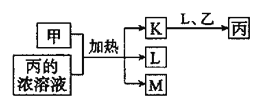
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,K、L、M均是由这些元素组成的氧化物,甲、乙分别是元素Y、W的单质,甲是常见的固体,乙是常见的气体。K是红棕色气体,丙的浓溶液具有强氧化性,上述物质的转化关系如图所示。下列说法错误的是( )
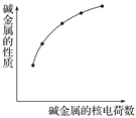
A.X、Y、Z三种元素的第一电离能:![]()
B.X分别与Y、Z、W形成的分子中均可能含有非极性共价键
C.Z元素的最高价含氧酸的酸性在同周期和同主族元素中均最强
D.若固体![]() 是由直线形的
是由直线形的![]() 和平面三角形的
和平面三角形的![]() 组成,则
组成,则![]() 与丙溶液中的溶质阴离子相同
与丙溶液中的溶质阴离子相同
【答案】A
【解析】
K是红棕色气体,丙的浓溶液具有强氧化性,K是NO2,丙为浓HNO3,可知乙是O2,L为H2O,甲是常见的固体,与浓HNO3反应生成NO2,所以甲为C,M为CO2,所以X、Y、Z、W分别是H、C、N、O四种元素,据此解答。
A.第一电离能是基态的气态原子失去最外层的一个电子所需能量,同周期元素第一电离能从左到右增大,H原子比碳原子的核外电子距离原子核近,受到原子核的引力大,电离需要消耗更多的能量,所以第一电离能比C的大,N原子的2p能级处于半充满状态,比较稳定,第一电离能较大,H、C、N三种元素的第一电离能为:N>H>C ,A错误;
B.H与C、N、O形成的分子中,C2H4、N2H4、H2O2中都含有非极性共价键,B正确;
C.Z为N元素,N在元素周期表第二周期第VA族,由于O、F无正价,第二周期中元素的最高价氧化物的水化物中HNO3酸性最强;第VA族中N非金属性最强,故第VA族中最高价氧化物的水化物中HNO3酸性最强,C正确;
D.N2O5在固态时由![]() 和
和![]() 构成,其中
构成,其中![]() 呈直线型,
呈直线型,![]() 呈平面三角形,丙溶液为硝酸,所以Q与丙溶液中的溶质阴离子相同,D正确。
呈平面三角形,丙溶液为硝酸,所以Q与丙溶液中的溶质阴离子相同,D正确。
答案为A。

练习册系列答案
相关题目