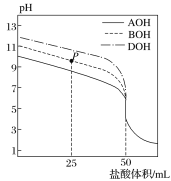
题目内容
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是
A. 常温常压下,124gP4中所含P—P键数目为6NA
B. 标况下,2.24L装有NO2气体的密闭容器中,含有的分子数为0.1NA
C. 标况下,11.2L的SO3溶于水得到0.5mol的H2SO4
D. 密闭容器中,1molN2和3molH2催化反应后分子总数为2NA
【答案】A
【解析】
1molP4中P—P键数目为6mol;二氧化氮在标况下存在自发的可逆反应;三氧化硫在标况下不是气体;氮气和氢气催化反应为可逆反应。
A. 常温常压下,124gP4物质的量是1mol,含有P—P键6mol,故所含P—P键数目为6NA,A正确;
B. 标况下,2.24L NO2物质的量是0.1mol,在密闭环境下存在可逆反应2NO2![]() N2O4,含有的分子数小于0.1NA,B错误;
N2O4,含有的分子数小于0.1NA,B错误;
C. 标况下,SO3不属于气体,故仅已知体积情况下,无法计算,C错误;
D. 密闭容器中,1molN2和3molH2催化反应为可逆反应,N2+3H2![]() 2NH3,分子总数大于2NA,D错误;
2NH3,分子总数大于2NA,D错误;
答案为A。

 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案【题目】下表中列出了25C、101kPa时一些物质的燃烧热数据
物质 | CH4 | C2H2 | H2 |
燃烧热/( kJ·mol-1) | 890.3 | 1299.6 | 285.8 |
已知键能:C—H键:413.4 kJ·mol-1、H—H键:436 kJ·mol-1,乙炔的结构是为H—C![]() C—H则下列叙述正确的是( )
C—H则下列叙述正确的是( )
A.2H2(g) + 2O2(g) = 2H2O(g) ΔH = -571.6 kJ·mol-1
B.CH4和C2H2中所含化学键完全相同
C.2CH4(g) = C2H2(g) + 3H2(g) ΔH = -376.4 kJ·mol-1
D.C![]() C键能为796 kJ·mol-1
C键能为796 kJ·mol-1
【题目】铁在生产生活中应用最广泛,炼铁技术和含铁新材料的应用倍受关注。
(1)高炉炼铁是冶炼铁的主要方法,发生的主要反应有:
反应 | △H(kJ/mol) | K |
i. Fe2O3(s)+3C(s) | +489 | K1 |
ii. Fe2O3(s)+3CO(g) | X | K2 |
iii. C(s)+CO2(g) | +172 | K3 |
试计算,X=_____,K1、K2与K3之间的关系为____________。
(2)T1℃时,向某恒温密闭容器中加入一定量的Fe2O3和C,发生反应i,反应达到平衡后,在t1时刻,改变某条件,V(逆)随时间(t)的变化关系如图1所示,则t1时刻改变的条件可能是_____(填写字母)。
a.保持温度不变,压缩容器 b.保持体积不变,升高温度
c.保持体积不变,加少量碳粉 d.保持体积不变,增大CO浓度
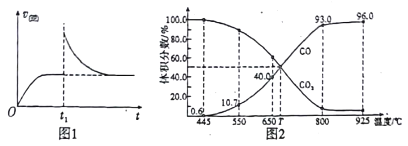
(3)在一定温度下,向某体积可变的恒压密闭容器(p总)加入1molCO2 与足量的碳,发生反应ⅲ,平衡时体系中气体体积分数与温度的关系如图2 所示。
①650℃时,该反应达平衡后吸收的热量是______。(计算时不考虑温度对△H的影响)
②T℃时,若向平衡体系中再充入一定量按V(CO2):V(CO) =5:4的混合气体,平衡_____(填“ 正向”、“ 逆向”或“ 不” )移动。
③925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp为_____。[气体分压(p分)=气体总压(p总) ×体积分数,用某物质的平衡分压代替物质的量浓度也可以表示化学平衡常数,记作Kp]
(4)用原电池原理可以除去酸性废水中的三氯乙烯、AsO3-,其原理如图3所示( 导电壳内部为纳米零价铁)。
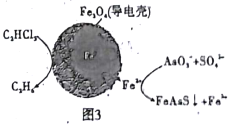
在除污过程中,纳米零价铁中的Fe为原电池的______极 (填“正"或“负”),写出C2HCl3在其表面被还原为乙烷的电极反应式为_____________。