题目内容
【题目】一定条件下的可逆反应CO(g)+2H2(g)![]() CH3OH(g) △H <0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是( )
CH3OH(g) △H <0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是( )
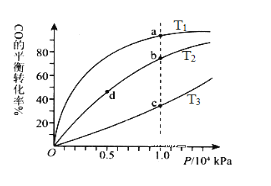
A.温度:T1< T2 <T3
B.正反应速率:ν(a)>ν(c); ν(b)>ν(d)
C.平衡常数: K(a) =K(c) ;K(b) >K(d)
D.平均摩尔质量:M(a)<M(c);M(b)>M(d)
【答案】A
【解析】
A.该反应的正反应方向是放热反应,随着温度的升高,平衡向逆反应方向进行,CO的转化率降低,因此根据图像,在相同压强下,得出T1<T2<T3,故A说法正确;
B.a点和c点相比,压强相同,a点对应的温度小于c点温度,温度越高,反应速率越大,即v(a)<v(c),对比bd两点,具有相同的温度,但b点压强大于d点,压强越大,反应速率越大,即v(b)>v(d),故B说法错误;
C.平衡常数只受温度的影响,该反应为放热反应,升高温度,化学平衡常数降低,a点温度低于c点,因此K(a)>K(c),bd温度相同,则K(b)=K(d),故C说法错误;
D.根据![]() 进行分析,组分都是气体,开始时通入量相同,因此混合气体质量相同,CO转化率越大,气体总物质的量越小,a点气体总物质的量最小,即M(a)>M(c),M(b)>M(d),故D说法错误;
进行分析,组分都是气体,开始时通入量相同,因此混合气体质量相同,CO转化率越大,气体总物质的量越小,a点气体总物质的量最小,即M(a)>M(c),M(b)>M(d),故D说法错误;
答案:A。

【题目】(1)100°C时,KW=1.0×10-12,在该温度下,测得0.1mol/L Na2A溶液pH=6。
①H2A在水溶液中的电离方程式为_____;
②体积相等pH=1的盐酸与H2A溶液分别与足量的Zn反应,H2A溶液产生的H2_____(填“多”、“少”或“一样多”)。
(2)将0.4mol/L HA溶液与0.2mol/L NaOH溶液等体积混合,测得混合溶液中c(Na+)>c(A-):
①混合溶液中c(A)_____c(HA)(填“>”、“<”或“=”,下同);
②混合溶液中c(HA)+c(A)_____0.2mol/L。
(3)已知在常温下测得浓度均为0.1mol/L的下列5种溶液的pH,如表所示:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①少量二氧化碳通入NaClO溶液中的离子方程式_____;
②浓度均为0.01mol/L的下列4种物质的溶液分别加水稀释100倍,pH变化最小的是_____(填编号);
a.CH3COOH b.HCN c.HClO d.H2CO3
③常温下浓度相同的醋酸和醋酸钠混合液pH=6,则c(CH3COO-)-c(CH3COOH)=_____mol/L(填准确数值)。