题目内容
【题目】在一定温度下,把1molN2和3molH2通入一个一定容积的密闭的容器里,发生如下反应:N2+3H2![]() 2NH3;当此反应进行到一定程度时,反应混和物就处于化学平衡状态。现在该容器中,维持温度不变,令a、b、c分别代表初始加入的N2、H2和NH3的物质的量(mol)。如果a、b、c取不同的数值,它们必须满足一定的相互关系,才能保证达到平衡时,反应混合物中三种气体的百分含量仍跟上述平衡时的完全相同。请填写下列空白:
2NH3;当此反应进行到一定程度时,反应混和物就处于化学平衡状态。现在该容器中,维持温度不变,令a、b、c分别代表初始加入的N2、H2和NH3的物质的量(mol)。如果a、b、c取不同的数值,它们必须满足一定的相互关系,才能保证达到平衡时,反应混合物中三种气体的百分含量仍跟上述平衡时的完全相同。请填写下列空白:
(1)若a=0,b=0,则c=__________。
(2)若a=0.5,则b=__________和c=__________。
(3)a、b、c取值必须满足的一般条件是:请用两个方程式表示,其中一个只含a和c,另一个只含b和c______。
【答案】2 1.5 1 ![]() ;
;![]()
【解析】
给据题给信息,本题为恒温恒容条件下等效平衡的判断和计算。首先分析可逆反应,可知该反应为反应前后气体分子数不等的可逆反应。对于这样的可逆反应,要保证反应混合物中三种气体的百分含量仍跟上述平衡时的完全相同,即要与原平衡等效,则投入的物质的量换算成同一边物质,应与之前相应物质的投入量相等。据此进行计算判断。
(1)根据反应方程式,将1molN2和3molH2换算成NH3的量,为2mol,则可知2molNH3相当于1molN2和3molH2,则c=2,答案为:2;
(2)根据反应方程式,有:
N2+3H2![]() 2NH3
2NH3
![]()
根据等效平衡有: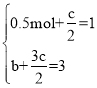 ,解得:
,解得:![]() ,答案为:1.5;1;
,答案为:1.5;1;
(3)根据题意有:
N2+3H2![]() 2NH3
2NH3
![]()
根据等效平衡有: ,答案为:
,答案为:![]() ;
;![]() 。
。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目