题目内容
【题目】草酸亚铁晶体(FeC2O42H2O,M=180g/mol)呈淡黄色,可用作晒制蓝图。某实验小组对其进行了一系列探究。
I.纯净草酸亚铁晶体热分解产物的探究
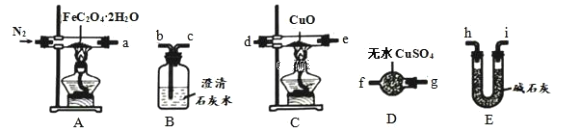
(1)气体产物成分的探究。小组成员采用如下装置(可重复选用)进行实验:
①按照气流从左到右的方向,上述装置的接口顺序为 a→g→f→___________→尾气处理装置(仪器可重复使用)。
②实验前先通入一段时间 N2,其目的为__________。
③实验证明了气体产物中含有 CO,依据的实验现象为__________。
(2)小组成员设计实验证明了 A 中分解后的固体成分为 FeO,则草酸亚铁晶体分解的化学方程式为__________。
(3)晒制蓝图时,以 K3[Fe(CN)6]溶液为显色剂,该反应的化学方程式为__________。
Ⅱ.草酸亚铁晶体样品纯度的测定:工业制得的草酸亚铁晶体中常含有 FeSO4 杂质,测定其纯度的步骤如下:
步骤 1:称取 mg 草酸亚铁晶体样品并溶于稀 HSO4 中,配成 250mL 溶液;
步骤 2:取上述溶液 25.00mL,用 cmol/L KMnO4 标准液滴定至终点,消耗标准液 V1mL;
步骤 3:向反应后溶液中加入适量锌粉,充分反应后,加入适量稀 H2SO4,再用 cmol/L KMnO4 标准溶液滴定至终点,消耗标准液 V2mL。
(4)步骤 2 中滴定终点的现象为__________;步骤 3 中加入锌粉的目的为__________。
(5)草酸亚铁晶体样品的纯度为__________;若步骤 1配制溶液时部分Fe2+被氧化变质,则测定结果将__________(填“偏高”、“偏低”或“不变”)。
【答案】b→c→h→i(或i→h)→d→e→b→c 排尽装置中的空气,防上加热时发生爆炸 C中固体由黑色变为红色,后B装置中出现浑浊 FeC2O4·2H2O![]() FeO+CO↑+CO2↑+2H2O 3FeC2O4+2K3[FeCN)6]=Fe3[Fe(CN)6]2+3K2C2O4 锥形瓶中溶液颜色变为浅紫色,且30s内不褪色 将Fe3+还原为Fe2+
FeO+CO↑+CO2↑+2H2O 3FeC2O4+2K3[FeCN)6]=Fe3[Fe(CN)6]2+3K2C2O4 锥形瓶中溶液颜色变为浅紫色,且30s内不褪色 将Fe3+还原为Fe2+  ×100% 偏低
×100% 偏低
【解析】
Ⅰ.(1)①气体产物成分的探究,草酸亚铁晶体在装置A中加热分解,生成的气体通过装置D中硫酸铜检验水蒸气的存在,通过装置B中澄清石灰水检验二氧化碳的生成,通过装置E中碱石灰干燥气体后,通入装置C中玻璃管中和氧化铜反应生成铜和二氧化碳,再通过B装置检验生成的二氧化碳气体,最后尾气处理;
②验前先通入一段时间N2,把装置内空气赶净,防止加热爆炸;
③实验证明了气体产物中含有CO,是利用一氧化碳的还原性还原氧化铜生成红色铜和二氧化碳设计实验验证;
(2)依据结论,可知A处反应管中发生反应是草酸亚铁晶体分解生成氧化亚铁、一氧化碳、二氧化碳和水;
(3)FeC2O4与反应K3[Fe(CN)6]生成蓝色的Fe3[Fe(CN)6]2沉淀,同时生成K2C2O4;
Ⅱ.(4)用 cmolL-1 KMnO4标准液滴定至终点,滴入最后一滴溶液无色变化为紫红色且半分钟不变,说明反应进行到终点,向反应后溶液中加入适量锌粉是将Fe3+还原为Fe2+;
(5)草酸亚铁溶液中滴入高锰酸钾溶液,发生氧化还原反应,亚铁离子和草酸根离子都被氧化,向反应后溶液中加入适量锌粉,充分反应后,加入适量稀H2SO4,再用cmolL-1KMnO4标准溶液滴定至终点,消耗标准液V2mL,此时滴定的是亚铁离子,第一次消耗高锰酸钾减去第二次高锰酸钾为滴定亚铁离子的量,利用化学反应定量关系计算,若步骤1配制溶液时部分Fe2+被氧化,消耗高锰酸钾减少,计算得到亚铁离子物质的量减小。
Ⅰ.(1)①草酸亚铁晶体在装置A中加热分解,生成的气体通过装置D中硫酸铜检验水蒸气的存在,通过装置B中澄清石灰水检验二氧化碳的生成,通过装置E中碱石灰干燥气体后通入装置C中玻璃管中,和氧化铜反应生成铜和二氧化碳,再通过B装置检验生成的二氧化碳气体,按照气流从左到右的方向,上述装置的连接顺序为:agfbchi(或ih)de(或ed)bc,最后连接尾气处理装置,正确的顺序为:agfbchi(或ih)de(或ed)bc;
故答案为:bchi(或ih)de(或ed)bc;
②实验前先通入一段时间N2,其目的为:排尽装置中的空气,防止加热时发生爆炸;
故答案为:排尽装置中的空气,防止加热时发生爆炸;
③实验证明了气体产物中含有CO,依据的实验现象为:C处反应管中固体由黑变红,其后的B装置中澄清石灰水变浑浊;
故答案为:C处反应管中固体由黑变红,其后的B装置中澄清石灰水变浑浊;
(2)A处反应管中发生反应是草酸亚铁晶体分解生成氧化亚铁、一氧化碳、二氧化碳和水,反应的化学方程式为:FeC2O4·2H2O![]() FeO+CO↑+CO2↑+2H2O,
FeO+CO↑+CO2↑+2H2O,
故答案为:FeC2O4·2H2O![]() FeO+CO↑+CO2↑+2H2O;
FeO+CO↑+CO2↑+2H2O;
(3)FeC2O4与反应K3[Fe(CN)6]生成蓝色的Fe3[Fe(CN)6]2沉淀,同时生成K2 C2O4,该反应的化学方程式为:3FeC2O4+2K3[FeCN)6]=Fe3[Fe(CN)6]2+3K2C2O4;
故答案为:3FeC2O4+2K3[FeCN)6]=Fe3[Fe(CN)6]2+3K2C2O4 ;
Ⅱ.(4)用 cmolL1 KMnO4标准液滴定至终点,滴入最后一滴溶液,无色变化为紫红色且半分钟不变,说明反应进行到终点,步骤3中加入锌粉的目的为:将Fe3+还原为Fe2+;
故答案为:滴入最后一滴溶液无色变化为紫红色且半分钟不变,说明反应进行到终点;将Fe3+还原为Fe2+;
(5)取上述溶液25.00mL,用cmolL 1KMnO4标准液滴定至终点,消耗标准液V1mL,向反应后溶液中加入适量锌粉,充分反应后,加入适量稀H2SO4,再用cmolL1KMnO4标准溶液滴定至终点,消耗标准液V2mL,第一次消耗高锰酸钾减去第二次高锰酸钾为滴定亚铁离子的量,为亚铁离子消耗高锰酸钾物质的量,反应的离子方程式:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;草酸亚铁晶体样品的纯度=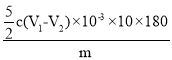 ×100% ;若步骤1配制溶液时部分Fe2+被氧化,消耗高锰酸钾减少,计算得到亚铁离子物质的量减小,测定结果偏低;
×100% ;若步骤1配制溶液时部分Fe2+被氧化,消耗高锰酸钾减少,计算得到亚铁离子物质的量减小,测定结果偏低;
故答案为: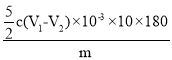 ×100% ; 偏低。
×100% ; 偏低。

 阅读快车系列答案
阅读快车系列答案【题目】Ⅰ.甲醇是重要的化学工业基础原料和清洁液体燃料,工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如表所示:
化学反应 | 平衡常数 | 温度℃ | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g) | K3 | ||
(1)据反应①与②可推导出K1、K2与K3之间的关系,则K3=__________(用K1、K2表示)
(2)反应③的ΔS__________0(填“>”、“<”);反应③的ΔH__________0(填“>”、“<”)
(3)500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol/L)分别为0.8、0.1、0.3、0.15,则此时V正__________V逆(填“>”、“=”或“<”)
Ⅱ.一定条件下,在容积为2L的密闭容器中充入lmolCO与2molH2合成甲醇,平衡转化率与温度、压强的关系如图所示:
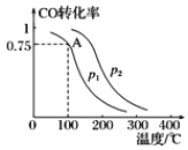
(1)p1__________p2(填“>”、“=”或“<”)。
(2)该反应达到平衡时,反应物转化率的关系是CO____________H2(填“>”、“=”或“<”)。
(3)若100℃P1时达平衡所用的时间为5min,则从开始到平衡这段时间用H2表示的速率为_______________________。
(4)该甲醇合成反应在A点的平衡常数K=___________。