题目内容
【题目】.Ba(NO3)2可用于生产烟花。某主要生产 BaCl2、BaCO3、BaSO4 的化工厂利用某种钡泥[主要含有 BaCO3、Ba(FeO2)2、极少量 CuCO3 等]制取 Ba(NO3)2 晶体,其部分工艺流程如下:
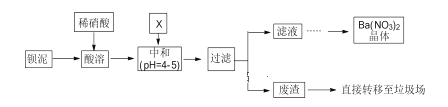
已知:Fe3+和Fe2+以氢氧化物形式沉淀完全时,溶液的 pH 分别为 3.2 和 9.7。
(1)酸溶时通常不使用浓硝酸的原因是__________。
(2)酸溶后溶液中pH=1,Ba(FeO2)2 与HNO3 的反应化学方程式为____________。
(3)该厂结合本厂实际,中和选用的 X 为__________(填化学式);中和使溶液中__________(填离子符号)的浓度减少(中和引起的溶液体积变化可忽略)。
(4)滤液得到 Ba(NO3)2 晶体的操作依次为_____、过滤。
(5)该厂生产的 Ba(NO3)2 晶体含有少量 Cu2+ ,可通过洗涤的方法除去。证明晶体已经洗涤干净的操作方法是_______________________。
(6)Ba2+致死量为355mg/kg。误食Ba2+可以服用MgSO4 溶液解毒,涉及到的离子反应方程式为___________; 为了减少环境污染,请对上述流程中不合理的设计进行改进,改进措施是___________。
【答案】浓HNO3易挥发、分解 Ba(FeO2)2+8HNO3=Ba(NO3)2+2Fe(NO3)3+4H2O BaCO3 Fe3+、H+ 蒸发浓缩、冷却结晶 取最后一次洗涤液 少许于试管中,滴加NaOH溶液无蓝色沉淀产出 Ba2+ + SO42-=BaSO4 ↓ 洗涤废渣并回收洗涤液
【解析】
BaCO3含少量CuCO3 ,Ba(FeO2)2、Ba(NO3)2等杂质,其中Ba(FeO2)2中钡元素为+2价,铁元素为+3价,加入硝酸,在容器中充分溶解得到溶液,此溶液中含有钡离子,铜离子,三价铁离子,可加入X是碳酸钡,调节溶液pH=4-5,使铁离子,铜离子水解生成氢氧化铁沉淀,氢氧化铜沉淀,过滤后废渣是氢氧化铁,氢氧化铜,滤液中主要含有硝酸,硝酸钡,经蒸发浓缩,冷却结晶,过滤可得硝酸钡晶体。
(1)酸溶时不使用的原因是浓硝酸易挥发,分解;
(2)酸溶后溶液中中pH=1,Ba(FeO2)2 与HNO3 的反应生成硝酸钡,硝酸铁和水,反应的化学方程式为Ba(FeO2)2+8HNO3=Ba(NO3)2+2Fe(NO3)3+4H2O;
(3)该厂结合本厂实际,中和选用的 X必须能消耗过量硝酸并使铁离子沉淀而除去,且不引人新的杂质,可为BaCO3;中和使溶液中Fe3+、H+浓度减少;
(4)滤液得到硝酸钡晶体的操作依次为蒸发浓缩、冷却结晶;
(5)晶体表面可能有Cu2+ ,如果洗涤干净,说明没有Cu2+ ,所以操作是取最后一次洗涤液 少许于试管中,滴加NaOH溶液无蓝色沉淀产出;
(6)误食Ba2+可以服用MgSO4 溶液解毒,涉及到的离子反应方程式为Ba2+ + SO42-=BaSO4 ↓;避免引起污染,改进措施是洗涤废渣并回收洗涤液;

 阅读快车系列答案
阅读快车系列答案


