题目内容
【题目】今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,A、B、C、D为短周期主族元素,其中A、B、C在周期表中所处的位置如图所示,且它们的质子数之和为32。D元素原子的最外层电子数为次外层电子数的2倍。下列说法正确的是

A.原子半径:D>A>CB.常温常压下,B单质为固态
C.气态氢化物热稳定性:B>CD.C的最高价氧化物的水化物是强酸
【答案】AB
【解析】
A、B、C、D为短周期主族元素,其中A、B、C在周期表中所处的位置且它们的质子数之和为32,设B上面的元素质子数为x,则A质子数为x-1,C质子数为x+1,B的质子数为x+8,因此有x-1 + x+1 +x +8 =32,x = 8,则A为N,B为S,C为F,D元素原子的最外层电子数为次外层电子数的2倍,则D为C。
A选项,从左到右原子半径逐渐减小,从上到下,原子半径逐渐增大,所以原子半径:C>N> F,故A正确;
B选项,常温常压下,B为单质硫,是固态,故B正确;
C选项,元素的非金属性越强,气态氢化物稳定性越强,因此气态氢化物热稳定性:HF > H2S,故C错误;
D选项,C元素为F,F元素没有最高价氧化物的水化物,故D错误;
综上所述,答案为AB。

【题目】Ⅰ.甲醇是重要的化学工业基础原料和清洁液体燃料,工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如表所示:
化学反应 | 平衡常数 | 温度℃ | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g) | K3 | ||
(1)据反应①与②可推导出K1、K2与K3之间的关系,则K3=__________(用K1、K2表示)
(2)反应③的ΔS__________0(填“>”、“<”);反应③的ΔH__________0(填“>”、“<”)
(3)500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol/L)分别为0.8、0.1、0.3、0.15,则此时V正__________V逆(填“>”、“=”或“<”)
Ⅱ.一定条件下,在容积为2L的密闭容器中充入lmolCO与2molH2合成甲醇,平衡转化率与温度、压强的关系如图所示:
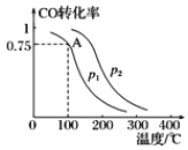
(1)p1__________p2(填“>”、“=”或“<”)。
(2)该反应达到平衡时,反应物转化率的关系是CO____________H2(填“>”、“=”或“<”)。
(3)若100℃P1时达平衡所用的时间为5min,则从开始到平衡这段时间用H2表示的速率为_______________________。
(4)该甲醇合成反应在A点的平衡常数K=___________。