题目内容
【题目】铝氢化钠(NaAlH4) 是有机合成的重要还原剂。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质) 为原料制备铝氢化钠的一种工艺流程如下:
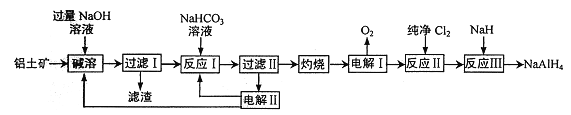
注: SiO2在“碱溶”时转化为铝硅酸钠(Na2Al2SixO8) 沉淀。
(1)铝硅酸钠(Na2Al2SixO8) 可以用氧化物的形式表示其组成,形式为________。
(2) “过滤I”中滤渣主要成分有________(写名称)。向“过滤I”所得滤液中加入NaHCO3溶液,反应的离子方程式为_______________、______________。
(3) “电解I”的另一产物在1000℃时可与N2反应制备AlN,在这种产物中添加少量NH4Cl固体并充分混合,有利于AlN 的制备,其主要原因是__________________。
(4)“电解II”是电解Na2CO3溶液,原理如图所示。
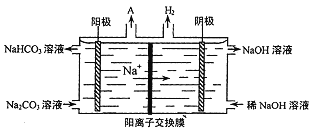
阳极的电极反应式为_________________。
(5)铝氢化钠遇水发生剧烈反应产生大量气泡,其反应的化学方程式为_____________,每产生1mol 气体转移电子数为______。
【答案】Na2O·Al2O3·2SiO2 铝硅酸钠、氧化铁 OH-+HCO3-=CO32-+H2O AlO2-+HCO3-+H2O=CO32-+Al(OH)3↓ 氯化铵分解产生的氯化氢能够破坏铝表面的氧化铝薄膜 4CO32-+2H2O-4e-=4HCO3-+O2↑ NaAlH4+2H2O=NaAlO2+4H2↑ NA
【解析】
以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝,由流程可知,加NaOH溶解时Fe2O3不反应,由信息可知SiO2在“碱溶”时转化为铝硅酸钠沉淀,过滤得到的滤渣为Fe2O3、铝硅酸钠,碳酸氢钠与偏铝酸钠反应生成Al(OH)3,过滤II得到Al(OH)3,灼烧生成氧化铝,电解I为电解氧化铝生成Al和氧气,电解II为电解Na2CO3溶液,结合图可知,阳极上碳酸根离子失去电子生成碳酸氢根离子和氧气,阴极上氢离子得到电子生成氢气。
(1)铝硅酸钠(Na2Al2SixO8)可以用氧化物的形式表示为Na2O·Al2O3·2SiO2,故答案为:Na2O·Al2O3·2SiO2;
(2) 根据上述分析,“过滤I”中滤渣主要有铝硅酸钠、氧化铁。向“过滤I”所得滤液中加入NaHCO3溶液,碳酸氢钠与偏铝酸钠和过量的氢氧化钠反应,反应的离子方程式为OH-+HCO3-=CO32-+H2O、AlO2-+HCO3-+H2O=CO32-+Al(OH)3↓,故答案为:铝硅酸钠、氧化铁;OH-+HCO3-=CO32-+H2O;AlO2-+HCO3-+H2O=CO32-+Al(OH)3↓;
(3)铝粉在1000℃时可与N2反应制备AlN,在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是NH4Cl分解产生的HCl能够破坏Al表面的Al2O3薄膜,使铝更容易与氮气反应,故答案为:NH4Cl分解产生的HCl能够破坏Al表面的Al2O3薄膜;
(4)由图可知,阳极反应为4CO32-+2H2O-4e-═4HCO3-+O2↑,阴极上氢离子得到电子生成氢气,故答案为:4CO32-+2H2O-4e-═4HCO3-+O2↑;
(5)铝氢化钠(NaAlH4)遇水发生剧烈反应产生大量气泡,反应生成偏铝酸钠和氢气,反应的化学方程式为NaAlH4+2H2O=NaAlO2+4H2↑,根据方程式,NaAlH4中H由-1价变成0价,H2O中H由+1价变成0价,每产生1mol氢气转移电子1mol,故答案为:NaAlH4+2H2O=NaAlO2+4H2↑;NA。

 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。
X | Y | ||||
Z | W | Q | |||
(1)Q的原子结构示意图是________。
(2)Y、Z、W形成简单离子,其离子半径关系为________(用离子符号表示)。
(3)用有关离子方程式表示Q、W元素的非金属性强弱______________
(4)Y的氢化物分子中含有18个电子,该分子中的共价键类型_____________________________。
(5)W的最高价氧化物对应的水化物的浓溶液与Cu反应的化学方程式为________________________。