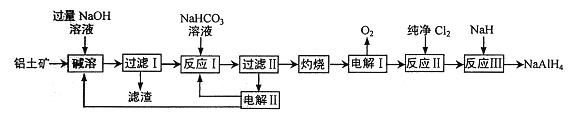
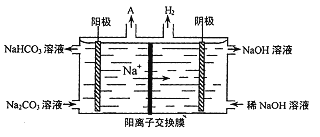
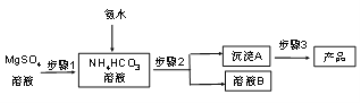
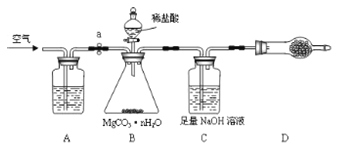
题目内容
【题目】向含4mol KNO3和2.5mol H2SO4的某稀溶液中加入1.5mol铁,充分反应后,产生的气体在标准状况下的体积为( )
A. 33.6LB. 28LC. 22.4LD. 11.2L
【答案】B
【解析】
n(H+)=2.5mol×2=5mol,n(NO3-)=4,发生3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O或Fe+NO3-+4H+=Fe3++NO↑+2H2O,铁粉的物质的量为1.5mol,由离子方程式判断过量,以此计算该题。
n(H+)=2.5mol×2=5mol,n(NO3-)=4,铁粉的物质的量为1.5mol,
由 3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O,
3 2 8
1.5mol 0.1mol 4mol
则1.5molFe完全反应时,硝酸根离子与氢离子均过量,则发生Fe+NO3-+4H+=Fe3++NO↑+2H2O,若1.5molFe完全反应时,氢离子不足,则两个反应均发生,
Fe+NO3-+4H+=Fe3++NO↑+2H2O
x 4x x
3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O
y![]() y
y![]() y
y
则x+y=1.5、4x+![]() y=5,解得x=0.75mol,y=0.75mol;
y=5,解得x=0.75mol,y=0.75mol;
生成NO的体积为(0.75mol+0.75mol×![]() )×22.4L/mol=28L,故答案为B。
)×22.4L/mol=28L,故答案为B。

练习册系列答案
相关题目