题目内容
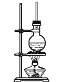
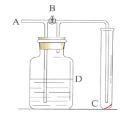
【题目】实验室制备Cl2通常采用如图所示装置:

(1)A装置中发生反应的化学方程式是________;每生成0.5 mol Cl2,被氧化的物质的物质的量是_____mol。
(2)仪器a的名称是_________;
(3)B装置中所盛的试剂是________________;
(4)实验时,通常采用密度为1.19 g/cm3、浓度为36.5%的浓盐酸。该浓盐酸的物质的量浓度为________;
(5)将如图装置代替装置D和E,可进行“氯气与金属钠反应”的实验,以下叙述正确的是________。
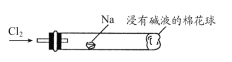
A. 反应生成的大量白烟是氯化钠晶体
B. 玻璃管尾部塞一团浸有碱液的棉球是用于吸收过量的氯气,以免其污染空气
C. 玻璃管中,钠燃烧时会产生苍白色火焰
D. 若在棉球外沿滴一滴淀粉碘化钾溶液,可据其颜色变化判断氯气是否被碱液完全吸收
(6)E装置中发生反应的化学方程式是________________;为验证E装置反应后的溶液中存在Cl-,正确的操作是_____________。
【答案】MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 1 分液漏斗 饱和食盐水 11.9 mol/L ABD Cl2+2NaOH=NaCl+NaClO+H2O 取少量烧杯内吸收Cl2的溶液于试管中,加入足量的稀硝酸酸化,再加入硝酸银溶液,若有白色沉淀生成,证明其中还有Cl-
MnCl2+Cl2↑+2H2O 1 分液漏斗 饱和食盐水 11.9 mol/L ABD Cl2+2NaOH=NaCl+NaClO+H2O 取少量烧杯内吸收Cl2的溶液于试管中,加入足量的稀硝酸酸化,再加入硝酸银溶液,若有白色沉淀生成,证明其中还有Cl-
【解析】
浓盐酸与MnO2混合加热反应产生Cl2,制取的Cl2中含有杂质HCl、H2O蒸气,先通过饱和NaCl溶液除去HCl,再通过浓硫酸干燥Cl2,然后在装置D中收集。由于Cl2是大气污染物,在排放前要进行尾气处理,可根据其与碱反应的性质,用NaOH溶液进行尾气处理,据此解答。
(1)在A装置中浓盐酸与MnO2混合加热反应产生Cl2,反应的化学方程式是MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;根据方程式可知:每反应产生1 mol Cl2,转移2 mol电子,氧化2 mol HCl,则反应生成0.5 mol Cl2,被氧化的HCl的物质的量是1 mol;
MnCl2+Cl2↑+2H2O;根据方程式可知:每反应产生1 mol Cl2,转移2 mol电子,氧化2 mol HCl,则反应生成0.5 mol Cl2,被氧化的HCl的物质的量是1 mol;
(2)根据装置图可知仪器a的名称是分液漏斗;
(3)B装置中所盛的试剂是饱和食盐水,作用是除去Cl2中的杂质HCl;
(4)密度为1.19 g/cm3、浓度为36.5%的浓盐酸的物质的量浓度c=![]() mol/L=11.9 mol/L;
mol/L=11.9 mol/L;
(5)Cl2与Na反应方程式为:2Na +Cl2![]() 2NaCl。
2NaCl。
A. 该反应产生NaCl白色固体,因此会看到有白烟现象,A正确;
B. 由于NaOH溶液能够与Cl2发生反应,所以玻璃管尾部塞一团浸有碱液的棉球是用于吸收过量的氯气,以免其污染空气,B正确;
C. 玻璃管中,钠燃烧时会产生黄色火焰,C错误;
D. 若Cl2未被NaOH溶液完全吸收,逸出的氯气会与KI发生反应:2KI+Cl2=2KCl+I2,产生的I2遇淀粉溶液变为蓝色,若完全被吸收,就不会出现蓝色,所以在棉球外沿滴一滴淀粉碘化钾溶液,可据其颜色变化判断氯气是否被碱液完全吸收,D正确;
故合理选项是ABD;
(6)在E装置中,Cl2与NaOH溶液发生反应的方程式为:Cl2+2NaOH=NaCl+NaClO+H2O;为验证E装置反应后的溶液中存在Cl-,正确的操作是取少量烧杯内吸收Cl2的溶液于试管中,先向溶液中加入HNO3酸化,再加入AgNO3溶液,若产生白色沉淀,就证明溶液中含Cl-,反应的离子方程式为Ag++Cl-=AgCl↓。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案