题目内容
【题目】常温下,用0.1000 mol·L-1的NaOH溶液与25.00 mL 0.1000 mol·L-1HA(-元酸)溶液进行滴定实验,得到滴定曲线(如图所示),下列说法不正确的是

A.HA为-元弱酸
B.常温下,HA的电离平衡常数Ka=10-5
C.M点时溶液的pH=7,此时加入的V(NaOH)<25.00 mL
D.可选用甲基橙作指示剂,到达滴定终点时溶液由红色变为黄色
【答案】D
【解析】
A. HA溶液的浓度为0.1000 mol·L-1,若为强酸其pH值应为1,从图中起点可看未滴加氢氧化钠时其pH值为3,故为弱酸,故A说法正确;
B.电离平衡常数 ,跟据图像起点可知,0.1000 mol·L-1HA溶液中c(H+)=1×10-3mol/L,根据电离方程式
,跟据图像起点可知,0.1000 mol·L-1HA溶液中c(H+)=1×10-3mol/L,根据电离方程式![]() ,可知c(A-)=1×10-3mol/L,所以
,可知c(A-)=1×10-3mol/L,所以![]() ,故B项正确;
,故B项正确;
C.当加入的V(NaOH)=25.00 mL,恰好完全反应,溶液中溶质为NaA,由于A-水解会使溶液显碱性,故溶液呈中性时加入的V(NaOH)<25.00 mL,故C项正确;
D.滴定终点溶液中溶质为NaA,由于A-水解会使溶液显碱性,应用酚酞做指示剂,故D项错误;
故答案为D。

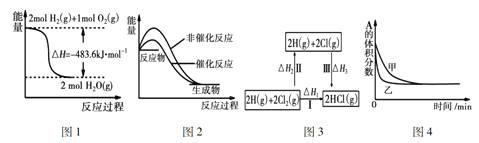
【题目】已知A--F六种有机化合物是重要的有机合成原料,结构简式见下表,请根据要求回答下列问题:
化合物 | A | B | C |
结构简式 |
|
|
|
化合物 | D | E | F |
结构简式 |
|
|
|
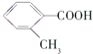
![]() 写出符合下列条件的A的同分异构体的结构简式: ______ 。
写出符合下列条件的A的同分异构体的结构简式: ______ 。
A.核磁共振氢谱有4组峰
B.能发生水解反应
C.在加热条件下能够与新制的氢氧化铜悬浊液生成砖红色沉淀
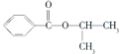
![]() 化合物B是制取抗心律失常药物--氟卡尼的中间体,下列有关描述不正确的是______
化合物B是制取抗心律失常药物--氟卡尼的中间体,下列有关描述不正确的是______ ![]() 填字母
填字母![]() 。
。
A.能与氯化铁溶液显色![]() 分子中含有羧基、羟基等官能团
分子中含有羧基、羟基等官能团
C.能与溴水反应![]() 能与碳酸钠溶液反应产生二氧化碳
能与碳酸钠溶液反应产生二氧化碳
![]() 化合物B在一定条件下,可以与NaOH溶液发生反应,则1mol化合物B最多需要NaOH的物质的量为 ______ 。
化合物B在一定条件下,可以与NaOH溶液发生反应,则1mol化合物B最多需要NaOH的物质的量为 ______ 。
![]() 化合物C与D在一定条件下发生如下转化得到高分子化合物Z,部分产物已略去。
化合物C与D在一定条件下发生如下转化得到高分子化合物Z,部分产物已略去。
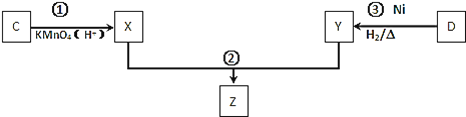
反应![]() 中D与
中D与![]() 按物质的量1:1反应生成Y,则反应
按物质的量1:1反应生成Y,则反应![]() 的化学方程式为 ______ 。
的化学方程式为 ______ 。
![]() 化合物D与银氨溶液反应的化学方程式
化合物D与银氨溶液反应的化学方程式![]() 有机物用结构简式表示
有机物用结构简式表示![]() : ______ 。
: ______ 。
![]() 化合物F是合成克矽平的原料之一,
化合物F是合成克矽平的原料之一,![]() 克矽平是一种治疗矽肺病的药物
克矽平是一种治疗矽肺病的药物![]() ,其合成路线如下
,其合成路线如下![]() 反应均在一定条件下进行
反应均在一定条件下进行![]() :
:

![]() 反应
反应![]() 是原子利用率
是原子利用率![]() 的反应,则该反应的化学方程式为 ______ ;
的反应,则该反应的化学方程式为 ______ ;
![]() 上述转化关系中没有涉及的反应类型是 ______
上述转化关系中没有涉及的反应类型是 ______ ![]() 填代号
填代号![]() 。
。
![]() 加成反应
加成反应![]() 消去反应
消去反应![]() 还原反应
还原反应![]() 氧化反应
氧化反应![]() 加聚反应
加聚反应![]() 取代反应。
取代反应。