题目内容
6.X、Y、Z、R、W是短周期主族元素,X原子的最外层电子数是其次外层的2倍,Y是地壳中含量最高的元素,Z元素的化合物的焰色反应呈黄色,R原子的核外电子数是X原子与Z原子的核外电子数之和,W与Y属于同一主族.下列叙述正确的是( )| A. | Y、Z、R元素简单离子的半径依次增大 | |
| B. | 含有Y、Z、R三种元素的化合物最多只有2种 | |
| C. | 元素W和R最高价氧化物对应水化物的酸性后者强 | |
| D. | Y与Z形成的两种化合物中的化学键类型和阴阳离子个数比均相同 |
分析 X、Y、Z、R、W是短周期主族元素,X原子最外层电子数是次外层的两倍,最外层电子数不超过8个,则其K层为次外层,故X是C元素;Y元素在地壳中的含量最高的元素,则Y是O元素;W与Y属于同一主族,则为W为S元素;Z元素的化合物的焰色反应呈黄色,则Z是Na元素;R原子的核外电子数是X原子与Z原子的核外电子数之和,其核外电子数为6+11=17,故R为Cl,据此解答.
解答 解:X、Y、Z、R、W是短周期主族元素,X原子最外层电子数是次外层的两倍,最外层电子数不超过8个,则其K层为次外层,故X是C元素;Y元素在地壳中的含量最高的元素,则Y是O元素;W与Y属于同一主族,则为W为S元素;Z元素的化合物的焰色反应呈黄色,则Z是Na元素;R原子的核外电子数是X原子与Z原子的核外电子数之和,其核外电子数为6+11=17,故R为Cl.
A.电子层结构相同的离子,核电荷数越大离子半径越小,电子层越多离子半径越大,则离子半径:Cl->O2->Na+,故A错误;
B.Y、Z、R分别是O、Na、Cl元素,含有三种元素的化合物有NaClO、NaClO2、NaClO3、NaClO4等,故B错误;
C.元素W和R最高价氧化物对应水化物分别为硫酸、高氯酸,高氯酸的酸性强于硫酸,故C正确;
D.Y与Z形成的两种化合物为Na2O、Na2O2,含有的阴阳离子数目之比均为1:2,前者只含离子键,后者含有离子键、共价键,故D错误,
故选:C.
点评 本题考查原子结构与元素周期律,侧重于学生的分析能力的考查,正确推断元素是解本题关键,B中注意根据Cl元素化合价理解O、Na、Cl元素形成的化合物,难度中等.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
16.利用铜萃取剂M,通过如图甲所示反应实现铜离子的富集:
(1)X难溶于水、易溶于有机溶剂,其晶体类型为分子晶体.
(2)M所含元素的电负性由大到小顺序为O>N>C>H,分子中碳原子的杂化方式有sp2、sp3.
(3)上述反应中断裂和生成的化学键有be(填序号).
a.离子键 b.配位键 c.金属键 d.范德华力 e.共价键
(4)M与W(分子结构如图乙)相比,M的水溶性小,更利于Cu2+的萃取.M水溶性小的主要原因是M能形成分子内氢键,使溶解度减小.
(5)基态Cu2+的外围电子排布式为3d9,Cu2+等过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律.判断Sc3+、Zn2+的水合离子为无色的依据是3d轨道上没有未成对电子(3d轨道上电子为全空或全满).
(6)某Y原子的价电子排布式是3s23p5,铜与Y形成的化合物的晶胞结构如图丙;
①晶体的化学式是CuCl.
②已知该晶体的密度为ρg•cm-3,阿伏伽德罗常数的值为NA,则该晶体中铜原子与Y原子之间的最短距离为=$\frac{\sqrt{3}}{4}\root{3}{\frac{4×99.5}{ρ{N}_{A}}}$×1010pm(只写计算式).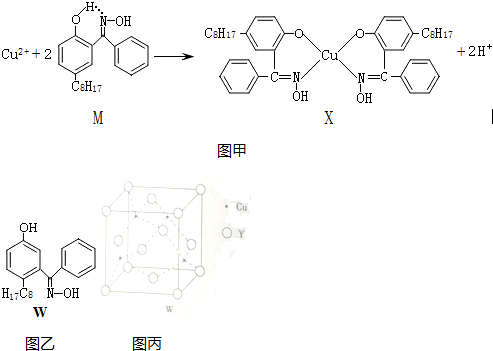
(1)X难溶于水、易溶于有机溶剂,其晶体类型为分子晶体.
(2)M所含元素的电负性由大到小顺序为O>N>C>H,分子中碳原子的杂化方式有sp2、sp3.
(3)上述反应中断裂和生成的化学键有be(填序号).
a.离子键 b.配位键 c.金属键 d.范德华力 e.共价键
(4)M与W(分子结构如图乙)相比,M的水溶性小,更利于Cu2+的萃取.M水溶性小的主要原因是M能形成分子内氢键,使溶解度减小.
(5)基态Cu2+的外围电子排布式为3d9,Cu2+等过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律.判断Sc3+、Zn2+的水合离子为无色的依据是3d轨道上没有未成对电子(3d轨道上电子为全空或全满).
| 离子 | Sc3+ | Ti3+ | Fe2+ | Cu2+ | Zn2+ |
| 颜色 | 无色 | 紫红色 | 浅绿色 | 蓝色 | 无色 |
①晶体的化学式是CuCl.
②已知该晶体的密度为ρg•cm-3,阿伏伽德罗常数的值为NA,则该晶体中铜原子与Y原子之间的最短距离为=$\frac{\sqrt{3}}{4}\root{3}{\frac{4×99.5}{ρ{N}_{A}}}$×1010pm(只写计算式).

1.不久前,某海军航空站安装了一台250kW的MCFC型燃料电池.该电池可同时供应电和水蒸气,其工作温度为600~700℃,所用燃料为H2,电解质为熔融的K2CO3.已知该电池的总反应为2H2+O2═2H2O,负极反应为H2+CO32--2e-═H2O+CO2,则下列推断正确的是( )
| A. | 正极反应为4OH-═O2+2H2O+4e- | |
| B. | 放电时CO32-向负极移动 | |
| C. | 电池供应1 mol水蒸气,转移电子4 mol | |
| D. | 氢氧燃料电池的H2和O2都贮存于电池中 |
11.下列叙述正确的是 ( )
| A. | 含有金属阳离子的晶体一定是离子晶体 | |
| B. | 化合物硫氰化铁和氢氧化二氨合银中都存在配位键 | |
| C. | KCl、HF、CH3CH2OH、SO2都易溶于水,且原因相同 | |
| D. | MgO的熔点比NaCl的高,主要是因为MgO的晶格能大于NaCl的晶格能. |
18.两种物质间反应生成相同物质的量的气体时,消耗酸的物质的量最少的是( )
| A. | 碳与浓硝酸 | B. | 铜与稀硝酸 | ||
| C. | 二氧化锰与浓盐酸 | D. | 铝与稀盐酸 |
15.X、Y、Z、W、Q是原子充数依次增大的前四周期元素,X的基态原子s电子总数是p电子总数的2倍;Z是地壳中含量最多的元素;W、Q同周期,且最外层电子数都为1,Q的核外电子排布中未成对电子数为6.下列说法错误的是( )
| A. | X、Y、Z的气态氢化物的稳定性依次增强 | |
| B. | XZ2分子中δ键与π键个数之比为1:1 | |
| C. | 原子半径由大到小的顺序:W>Z>Y | |
| D. | 由Z、W、Q三种元素形成的某种化合物可用于检查司机是否酒后驾车 |
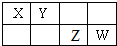 X、Y、Z、W是元素周期表中短周期元素,且原子序数依次递增,四种元素在元素周期表中的位置关系如图.四种元素的最高价含氧酸根离子一定能够水解的是( )
X、Y、Z、W是元素周期表中短周期元素,且原子序数依次递增,四种元素在元素周期表中的位置关系如图.四种元素的最高价含氧酸根离子一定能够水解的是( )