题目内容
【题目】下列说法正确的是( )
A.35Cl与37Cl互为同素异形体
B.O2与O3互为同位素
C.![]() 与CH3CH2CH2CH3互为同分异构体
与CH3CH2CH2CH3互为同分异构体
D.乙烯与CH3—C≡CH互为同系物
【答案】C
【解析】
本题主要考查同素异形体、同位素、同分异构体、同系物之间的联系与区别;
相同元素组成,不同形态的单质互为同素异形体;
有相同质子数,不同中子数的原子或同一元素的不同核素互为同位素;
具有相同分子式而结构不同的化合物互为同分异构体;
结构相似、分子组成相差若干个“CH2”原子团的有机化合物互相称为同系物。
A.35Cl与37Cl属于同位素,故A错误;
B.O2与O3为单质,不是元素的原子,不能称同位素,二者互为同素异形体,故B错误;
C.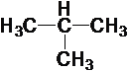 与CH3CH2CH2CH3分子式相同,结构不同互为同分异构体,故C正确;
与CH3CH2CH2CH3分子式相同,结构不同互为同分异构体,故C正确;
D.乙烯与CH3-C≡CH不是同一类物质,不属于同系物,故D错误;
故答案选C。

练习册系列答案
相关题目