题目内容
(9分)为了探究HClO的漂白性,某同学设计了如下的实验。
(1)通入Cl2后,从集气瓶A中干燥的红色布条的现象可得出的结论是 ;从集气瓶B中湿润的红色布条的现象可得出的结论是 ,其中发生的反应的化学方程式为 。
(2) 为了确证是HClO使湿润的红色布条褪色,你认为还应增加的实验是
为了确证是HClO使湿润的红色布条褪色,你认为还应增加的实验是  。
。
(3)烧杯中溶液所起的作用是 ,烧杯中所发生反应的化学方程式为  。
。
(4)为保证实验安全,当氯气以每分钟1.12L(标准状况)的流速匀速通入时,若实验需耗时4分钟,小烧杯中盛2 mol·L—1的NaOH溶液的体积至少应为多少?(写出计算过程)
(9分)(1)干燥的Cl2没有漂白性;湿润的Cl2(或氯水)有漂白性 Cl2+ H2O="HCl+" HClO
(2)验证HCl是否有漂白性
(3)吸收多余的Cl2 Cl2+2NaOH="NaCl+" NaClO+H2O (每空1分)
(4)
解析

练习册系列答案
相关题目



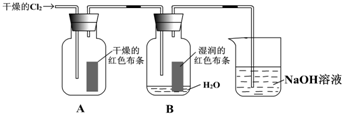
 为了探究HClO的漂白性,某同学设计了如下的实验.
为了探究HClO的漂白性,某同学设计了如下的实验.