题目内容
为了探究HClO的漂白性,某同学设计了如下的实验.
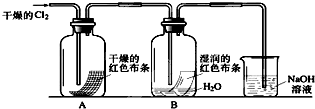
(1)通入Cl2后,从集气瓶A中干燥的红色布条的现象可得出的结论是
(2)为了确证是HClO使湿润的红色布条褪色,你认为还应增加的实验是
(3)烧杯中溶液所起的作用是
(4)为保证实验安全,当氯气以每分钟1.12L(标准状况)的流速匀速通入时,若实验需耗时4分钟,小烧杯中盛2mol?L-1的NaOH溶液的体积至少应为

(1)通入Cl2后,从集气瓶A中干燥的红色布条的现象可得出的结论是
干燥的氯气没有漂白性
干燥的氯气没有漂白性
;从集气瓶B中湿润的红色布条的现象可得出的结论是氯水具有漂白性
氯水具有漂白性
,其中发生的反应的化学方程式为Cl2+H2O=HCl+HClO
Cl2+H2O=HCl+HClO
.(2)为了确证是HClO使湿润的红色布条褪色,你认为还应增加的实验是
证明盐酸是否有漂白性
证明盐酸是否有漂白性
.(3)烧杯中溶液所起的作用是
吸收多余的氯气
吸收多余的氯气
,烧杯中所发生反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O
Cl2+2NaOH=NaCl+NaClO+H2O
.(4)为保证实验安全,当氯气以每分钟1.12L(标准状况)的流速匀速通入时,若实验需耗时4分钟,小烧杯中盛2mol?L-1的NaOH溶液的体积至少应为
200
200
mL.分析:(1)氯气能使湿润的有色布条褪色,但是不能使干燥的有色布条褪色,次氯酸具有漂白性,氯气没有漂白性;
(2)根据氯气和水反应的产物是盐酸和次氯酸,证明二者谁有漂白性即可;
(3)氯气有毒,可以用氢氧化钠来吸收;
(4)根据化学方程式进行计算.
(2)根据氯气和水反应的产物是盐酸和次氯酸,证明二者谁有漂白性即可;
(3)氯气有毒,可以用氢氧化钠来吸收;
(4)根据化学方程式进行计算.
解答:解:(1)氯气不能使干燥的有色布条褪色,干燥的氯气没有漂白性,氯气能使湿润的有色布条褪色,因为氯气和水反应生成的次氯酸具有漂白性,原理方程式为:Cl2+H2O=HCl+HClO,
故答案为:干燥的氯气没有漂白性;氯水具有漂白性;Cl2+H2O=HCl+HClO;
(2)氯气和水反应的产物是盐酸和次氯酸,要证明谁有漂白性,得做两个实验:证明盐酸是否有漂白性和证明次氯酸是否有漂白性的实验,故答案为:证明盐酸是否有漂白性;
(3)氯气有毒,会造成空气污染,可以用氢氧化钠来吸收,反应生成氯化钠、次氯酸钠和水,
故答案为:吸收多余的氯气;Cl2+2NaOH=NaCl+NaClO+H2O
(4)4分钟时n(Cl2)=
=0.2mol,根据反应方程式Cl2+2HaOH=NaCl+NaClO+H2O可知,
需要n(NaOH)=0.4mol,
所以V(NaOH)=
=0.2L=200mL,
故答案为:200.
故答案为:干燥的氯气没有漂白性;氯水具有漂白性;Cl2+H2O=HCl+HClO;
(2)氯气和水反应的产物是盐酸和次氯酸,要证明谁有漂白性,得做两个实验:证明盐酸是否有漂白性和证明次氯酸是否有漂白性的实验,故答案为:证明盐酸是否有漂白性;
(3)氯气有毒,会造成空气污染,可以用氢氧化钠来吸收,反应生成氯化钠、次氯酸钠和水,
故答案为:吸收多余的氯气;Cl2+2NaOH=NaCl+NaClO+H2O
(4)4分钟时n(Cl2)=
| 1.12L×4 |
| 22.4L/mol |
需要n(NaOH)=0.4mol,
所以V(NaOH)=
| 0.4mol |
| 2mol/L |
故答案为:200.
点评:本题考查HClO的漂白性的探究,题目难度不大,本题注意氯气与次氯酸性质的差异性,注意相关反应化学方程式或者离子方程式的书写.

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目
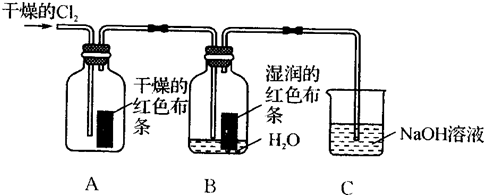
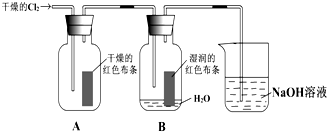
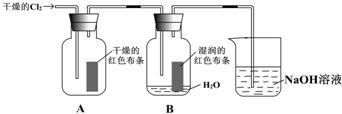
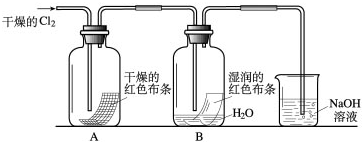 为了探究HClO的漂白性,某同学设计了如下的实验.
为了探究HClO的漂白性,某同学设计了如下的实验.