题目内容
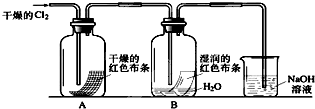
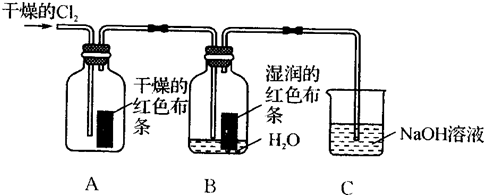
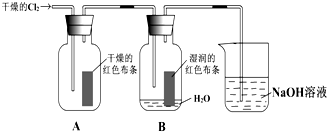
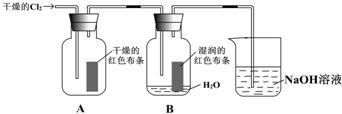
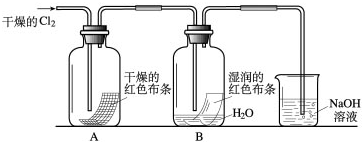 为了探究HClO的漂白性,某同学设计了如下的实验.
为了探究HClO的漂白性,某同学设计了如下的实验.(1)通入Cl2后,从集气瓶A中干燥的红色布条的现象可得出的结论是
(2)为了确证是HClO使湿润的红色布条褪色,你认为还应增加的实验是
(3)烧杯中溶液所起的作是
(4)为保证实验安全,当氯气以每分钟1.12L(标准状况)的流速匀速通入时,若实验需耗时4分钟,小烧杯中盛2mol?L-1的NaOH溶液的体积至少应为多少?(写出计算过程)
分析:(1)氯气能使湿润的有色布条褪色,但是不能使干燥的有色布条褪色,因为氯气与水反应会生成次氯酸和盐酸,次氯酸具有漂白性,氯气没有漂白性;
(2)根据氯气和水反应的产物是盐酸和次氯酸,为了证明次氯酸的漂白性还需要证明盐酸不能使有色布条褪色;
(3)氯气有毒,可以用氢氧化钠来吸收;
(4)根据氯气和氢氧化钠反应的方程式可以求得所需氢氧化钠的体积.
(2)根据氯气和水反应的产物是盐酸和次氯酸,为了证明次氯酸的漂白性还需要证明盐酸不能使有色布条褪色;
(3)氯气有毒,可以用氢氧化钠来吸收;
(4)根据氯气和氢氧化钠反应的方程式可以求得所需氢氧化钠的体积.
解答:解:(1)氯气不能使干燥的有色布条褪色,干燥的氯气没有漂白性,氯气能使湿润的有色布条褪色,因为氯气和水反应生成的次氯酸具有漂白性,
故答案为:干燥的氯气没有漂白性;氯水具有漂白性;
(2)氯气和水反应的产物是盐酸和次氯酸,要证明谁有漂白性,得做两个实验:证明盐酸是否有漂白性和证明次氯酸是否有漂白性的实验,故答案为:证明盐酸是否有漂白性;
(3)氯气有毒,会造成空气污染,可以用氢氧化钠来吸收,反应生成氯化钠、次氯酸钠和水,
故答案为:吸收多余的氯气;
(4)4分钟时n(Cl2)=0.2mol,根据反应方程式Cl2+2HaOH=NaCl+NaClO+H2O可知,
需要n(NaOH)=0.4mol,
所以V(NaOH)=
=0.2L=200mL,
答:NaOH溶液的体积至少应为200mL.
故答案为:干燥的氯气没有漂白性;氯水具有漂白性;
(2)氯气和水反应的产物是盐酸和次氯酸,要证明谁有漂白性,得做两个实验:证明盐酸是否有漂白性和证明次氯酸是否有漂白性的实验,故答案为:证明盐酸是否有漂白性;
(3)氯气有毒,会造成空气污染,可以用氢氧化钠来吸收,反应生成氯化钠、次氯酸钠和水,
故答案为:吸收多余的氯气;
(4)4分钟时n(Cl2)=0.2mol,根据反应方程式Cl2+2HaOH=NaCl+NaClO+H2O可知,
需要n(NaOH)=0.4mol,
所以V(NaOH)=
| 0.4mol |
| 2mol/L |
答:NaOH溶液的体积至少应为200mL.
点评:本题通过对HClO的漂白性的探究,考查学生灵活运用知识的能力和严密的化学逻辑思维能力及相关基本计算能力,题目难度虽然不大,但也具有一定的综合性,在答题时要注意规范的语言表达.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目