题目内容
二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。
(1)工业上用黄铁矿(FeS2,其中S元素为-l价)在高温下和氧气反应制备SO2:4FeS2+11O2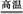 8SO2+2Fe2O3,该反应中被氧化的元素是 (填元素符号)。当该反应转移2.75 mol电子时,生成的二氧化硫在标准状况下的体积为 L。
8SO2+2Fe2O3,该反应中被氧化的元素是 (填元素符号)。当该反应转移2.75 mol电子时,生成的二氧化硫在标准状况下的体积为 L。
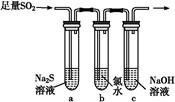
(2)实验室中用下列装置测定SO2催化氧化为SO3的转化率。(已知SO3熔点为16.8 ℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响。)

①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作是 。
②实验过程中,需要通入氧气。试写出一个用如图所示装置制取氧气的化学方程式 。
③当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是 。
④实验结束后,若装置D增加的质量为m g,装置E中产生白色沉淀的质量为n g,则此条件下二氧化硫的转化率是 (用含字母的代数式表示,不用化简)。
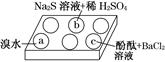
(3)某学习小组设计用如图装置验证二氧化硫的化学性质。
①能说明二氧化硫具有氧化性的实验现象为 。
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分成三份,分别进行如下实验:
方案Ⅰ:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液加入BaCl2溶液,产生白色沉淀
上述方案中合理的是 (填“Ⅰ”、“Ⅱ”或“Ⅲ”);试管b中发生反应的离子方程式为 。
③当通入二氧化硫至试管c中溶液显中性时,该溶液中c(Na+)= (用含硫微粒浓度的代数式表示)。
(1)工业上用黄铁矿(FeS2,其中S元素为-l价)在高温下和氧气反应制备SO2:4FeS2+11O2
 8SO2+2Fe2O3,该反应中被氧化的元素是 (填元素符号)。当该反应转移2.75 mol电子时,生成的二氧化硫在标准状况下的体积为 L。
8SO2+2Fe2O3,该反应中被氧化的元素是 (填元素符号)。当该反应转移2.75 mol电子时,生成的二氧化硫在标准状况下的体积为 L。 (2)实验室中用下列装置测定SO2催化氧化为SO3的转化率。(已知SO3熔点为16.8 ℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响。)

①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作是 。
②实验过程中,需要通入氧气。试写出一个用如图所示装置制取氧气的化学方程式 。

③当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是 。
④实验结束后,若装置D增加的质量为m g,装置E中产生白色沉淀的质量为n g,则此条件下二氧化硫的转化率是 (用含字母的代数式表示,不用化简)。
(3)某学习小组设计用如图装置验证二氧化硫的化学性质。

①能说明二氧化硫具有氧化性的实验现象为 。
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分成三份,分别进行如下实验:
方案Ⅰ:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液加入BaCl2溶液,产生白色沉淀
上述方案中合理的是 (填“Ⅰ”、“Ⅱ”或“Ⅲ”);试管b中发生反应的离子方程式为 。
③当通入二氧化硫至试管c中溶液显中性时,该溶液中c(Na+)= (用含硫微粒浓度的代数式表示)。
(1)S、Fe 11.2
(2)①打开分液漏斗上的活塞,旋开分液漏斗的旋塞,缓慢滴加。
②2KMnO4 K2MnO4+MnO2+O2↑或2KClO3
K2MnO4+MnO2+O2↑或2KClO3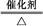 2KCl+3O2↑
2KCl+3O2↑
③使残留在装置中的二氧化硫和三氧化硫被充分吸收
④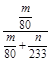 ×100%
×100%
(3)①a试管中有淡黄色沉淀生成
②Ⅲ Cl2+SO2+2H2O 4H++2Cl-+S
4H++2Cl-+S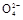
③2c(S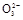 )+c(HS
)+c(HS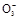 )
)
(2)①打开分液漏斗上的活塞,旋开分液漏斗的旋塞,缓慢滴加。
②2KMnO4
 K2MnO4+MnO2+O2↑或2KClO3
K2MnO4+MnO2+O2↑或2KClO3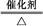 2KCl+3O2↑
2KCl+3O2↑③使残留在装置中的二氧化硫和三氧化硫被充分吸收
④
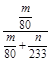 ×100%
×100%(3)①a试管中有淡黄色沉淀生成
②Ⅲ Cl2+SO2+2H2O
 4H++2Cl-+S
4H++2Cl-+S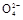
③2c(S
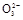 )+c(HS
)+c(HS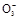 )
)(1)4FeS2+11O2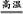 8SO2+2Fe2O3,该反应中被氧化的元素是S、Fe;设生成二氧化硫的体积是x L。
8SO2+2Fe2O3,该反应中被氧化的元素是S、Fe;设生成二氧化硫的体积是x L。
4FeS2+11O2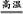 8SO2 +2Fe2O3 转移电子
8SO2 +2Fe2O3 转移电子
179.2 L 44 mol
x L 2.75 mol
x=11.2。
(2)①打开分液漏斗上的活塞,旋开分液漏斗的旋塞,缓慢滴加。
②加热KMnO4固体或KClO3和MnO2的固体混合物;
③使残留在装置中的SO2和SO3被充分吸收。
④在冰水状态下,SO3呈固态,所以装置D增加的质量即为SO3的质量,n(SO3)=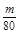 mol,装置E由于吸收了SO2而生成BaSO4白色沉淀,n(SO2)=n(BaSO4)=
mol,装置E由于吸收了SO2而生成BaSO4白色沉淀,n(SO2)=n(BaSO4)=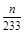 mol,由2SO2+O2
mol,由2SO2+O2 2SO3知,该反应消耗掉的n(SO2)=n(SO3)=
2SO3知,该反应消耗掉的n(SO2)=n(SO3)= 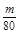 mol,所以二氧化硫的转化率为:
mol,所以二氧化硫的转化率为: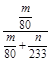 ×100%。
×100%。
(3)①Na2S和SO2发生氧化还原反应生成单质硫沉淀。
②Ⅲ合理,因为该白色沉淀为BaSO4,来源就是SO2被氧化;而方案Ⅰ:白色沉淀为AgCl,与SO2的还原性无关;方案Ⅱ验证的是SO2的漂白性。
③根据电荷守恒:c(Na+)+c(H+)=c(OH-)+2c(S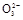 )+c(HS
)+c(HS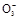 ),又溶液显中性,c(H+)=c(OH-),所以c(Na+)=2c(S
),又溶液显中性,c(H+)=c(OH-),所以c(Na+)=2c(S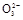 )+c(HS
)+c(HS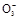 )。
)。
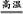 8SO2+2Fe2O3,该反应中被氧化的元素是S、Fe;设生成二氧化硫的体积是x L。
8SO2+2Fe2O3,该反应中被氧化的元素是S、Fe;设生成二氧化硫的体积是x L。4FeS2+11O2
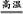 8SO2 +2Fe2O3 转移电子
8SO2 +2Fe2O3 转移电子179.2 L 44 mol
x L 2.75 mol
x=11.2。
(2)①打开分液漏斗上的活塞,旋开分液漏斗的旋塞,缓慢滴加。
②加热KMnO4固体或KClO3和MnO2的固体混合物;
③使残留在装置中的SO2和SO3被充分吸收。
④在冰水状态下,SO3呈固态,所以装置D增加的质量即为SO3的质量,n(SO3)=
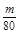 mol,装置E由于吸收了SO2而生成BaSO4白色沉淀,n(SO2)=n(BaSO4)=
mol,装置E由于吸收了SO2而生成BaSO4白色沉淀,n(SO2)=n(BaSO4)=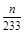 mol,由2SO2+O2
mol,由2SO2+O2 2SO3知,该反应消耗掉的n(SO2)=n(SO3)=
2SO3知,该反应消耗掉的n(SO2)=n(SO3)= 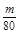 mol,所以二氧化硫的转化率为:
mol,所以二氧化硫的转化率为: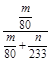 ×100%。
×100%。(3)①Na2S和SO2发生氧化还原反应生成单质硫沉淀。
②Ⅲ合理,因为该白色沉淀为BaSO4,来源就是SO2被氧化;而方案Ⅰ:白色沉淀为AgCl,与SO2的还原性无关;方案Ⅱ验证的是SO2的漂白性。
③根据电荷守恒:c(Na+)+c(H+)=c(OH-)+2c(S
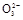 )+c(HS
)+c(HS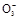 ),又溶液显中性,c(H+)=c(OH-),所以c(Na+)=2c(S
),又溶液显中性,c(H+)=c(OH-),所以c(Na+)=2c(S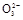 )+c(HS
)+c(HS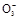 )。
)。
练习册系列答案
相关题目
 CO2(g) ?H=-283.0 kJ/mol
CO2(g) ?H=-283.0 kJ/mol