题目内容
以下每个选项中的两组物质都能反应,且能放出同一种气体的是( )
| A.铜与稀硫酸,铜与浓硫酸 |
| B.铁与稀硫酸,铁与浓硫酸 |
| C.硫化钠与稀硫酸,亚硫酸钠与稀硫酸 |
| D.硫化钠与稀硫酸,硫化钠与稀盐酸 |
D
铜与稀硫酸不反应,A项错误;铁与稀硫酸生成H2,铁与浓硫酸生成SO2,B项错误;硫化钠与稀硫酸生成H2S,亚硫酸钠与稀硫酸生成SO2,C项错误;D项都生成H2S气体。

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目
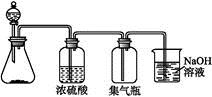
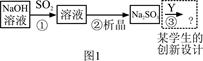
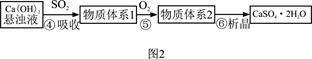
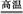 8SO2+2Fe2O3,该反应中被氧化的元素是 (填元素符号)。当该反应转移2.75 mol电子时,生成的二氧化硫在标准状况下的体积为 L。
8SO2+2Fe2O3,该反应中被氧化的元素是 (填元素符号)。当该反应转移2.75 mol电子时,生成的二氧化硫在标准状况下的体积为 L。 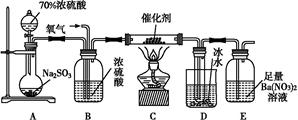
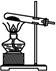
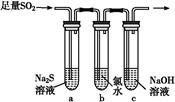
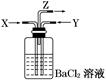
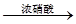 H2SO4
H2SO4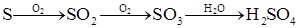
 H2SO3
H2SO3 2SO3
2SO3