题目内容
实验室用铜制备CuSO4溶液有多种方案,某实验小组给出了以下三种方案:
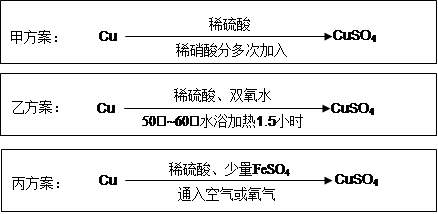
请回答有关问题:
(1)甲方案:
①写出该反应的离子方程式 ;
②为了节约原料,硫酸和硝酸的物质的量之比最佳为,n(H2SO4):n(HNO3)= 。
(2)乙方案:将6.4g铜丝放到90mL 1.5mol·L-1的稀硫酸中,控温在50℃。加入40mL 10%的H2O2,反应0.5小时,升温到60℃,持续反应1小时后,经一系列操作,得CuSO4·5H2O 20.0g【已知有关摩尔质 量:M(Cu)=64g/mol, M(CuSO4·5H2O) =250g/mol】。
①反应时温度控制在50℃~60℃,不宜过高的原因是 ;
②本实验CuSO4·5H2O的产率为 。
(3)丙方案:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,即发生反应,生成硫酸铜。反应完全后,加物质A调节pH至4 ,然后过滤、浓缩、结晶。
①物质A可选用以下的 (填序号);
②反应中加入少量FeSO4可加速铜的氧化,FeSO4的作用是 ;
(4)对比甲、乙、丙三种实验方案,丙方案的优点有(写两条):
、 。
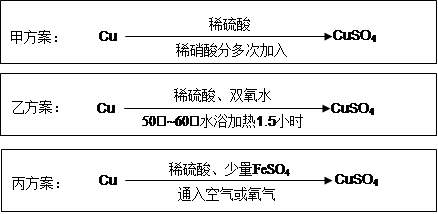
请回答有关问题:
(1)甲方案:
①写出该反应的离子方程式 ;
②为了节约原料,硫酸和硝酸的物质的量之比最佳为,n(H2SO4):n(HNO3)= 。
(2)乙方案:将6.4g铜丝放到90mL 1.5mol·L-1的稀硫酸中,控温在50℃。加入40mL 10%的H2O2,反应0.5小时,升温到60℃,持续反应1小时后,经一系列操作,得CuSO4·5H2O 20.0g【已知有关摩尔质 量:M(Cu)=64g/mol, M(CuSO4·5H2O) =250g/mol】。
①反应时温度控制在50℃~60℃,不宜过高的原因是 ;
②本实验CuSO4·5H2O的产率为 。
(3)丙方案:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,即发生反应,生成硫酸铜。反应完全后,加物质A调节pH至4 ,然后过滤、浓缩、结晶。
①物质A可选用以下的 (填序号);
| A.CaO | B.NaOH | C.CuCO3 | D.Cu2(OH)2CO3 E.Fe2(SO4)3 |
(4)对比甲、乙、丙三种实验方案,丙方案的优点有(写两条):
、 。
(1)①3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O (3分); ②3:2(2分)
(2)①双氧水受热易分解造成损耗(2分); ②80%(3分)
(3)①CD(2分); ②作催化剂(或起催化作用,2分)
(4)无污染;原料利用率高(或常温下反应,耗能少;原料便宜,成本低等)(2分)
(2)①双氧水受热易分解造成损耗(2分); ②80%(3分)
(3)①CD(2分); ②作催化剂(或起催化作用,2分)
(4)无污染;原料利用率高(或常温下反应,耗能少;原料便宜,成本低等)(2分)
试题分析:(1)①铜与稀硫酸、稀硝酸的混合液反应生成铜离子、NO、水,离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
②硫酸铜的化学式中Cu2+与SO42-的个数比是1:1,离子方程式中Cu2+与NO3-的个数比是是3:2,所以n(H2SO4):n(HNO3)=3:2;
(2)①因为过氧化氢受热易分解,温度过高,造成过氧化氢的损失,产率降低;
②604gCu的物质的量是0.1mol,硫酸的物质的量是0.135mol,所以硫酸过量,理论上应生成0.1molCuSO4·5H2O,质量是25.0g,实际得到CuSO4·5H2O 20.0g,所以CuSO4·5H2O的产率是20.0g/25.0g×100%=80%;
(3)①加物质A调节pH至4目的是降低溶液酸度,使铁元素沉淀,同时不引入新杂质,所以应选择CuCO3、Cu2(OH)2CO3,二者与硫酸反应生成硫酸铜、二氧化碳气体放出,符合题目要求,而ABE均会引入新杂质,答案选CD。
②反应中加入少量FeSO4可加速铜的氧化,而FeSO4不与溶液中的任何物质反应,所以FeSO4的作用只能是催化剂的作用;
(4)与甲、乙比,丙的优点是不会产生污染,耗能少,原料便宜,节约原料等。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
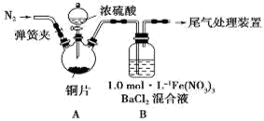

 H2SO3
H2SO3
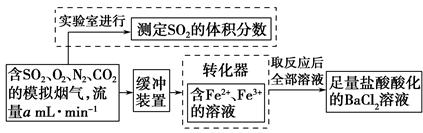
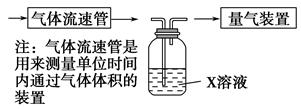
 的转化率,已知气体流速,还需测定的数据有 、 。
的转化率,已知气体流速,还需测定的数据有 、 。 8SO2+2Fe2O3,该反应中被氧化的元素是 (填元素符号)。当该反应转移2.75 mol电子时,生成的二氧化硫在标准状况下的体积为 L。
8SO2+2Fe2O3,该反应中被氧化的元素是 (填元素符号)。当该反应转移2.75 mol电子时,生成的二氧化硫在标准状况下的体积为 L。