题目内容
【题目】下图是中学化学中常见物质的转化关系,部分物质和反应条件略去。
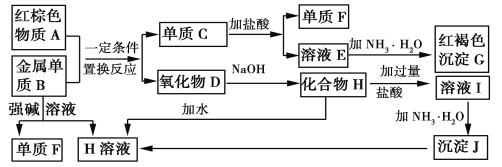
请回答下列问题:
(1)物质A的化学式为__________。
(2)写出单质B与强碱溶液反应的离子方程式____________________________。
(3)溶液E中加入氨水时,先生成白色沉淀L,L最终变为红褐色沉淀G,写出L变为G的化学反应方程式___________。
(4)溶液E敞口放置容易变质,为了防止溶液E的变质,可往溶液中加入___________。
(5)溶液I中所含金属离子是____________。
【答案】Fe2O3 2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑ 4Fe(OH)2+O2+2H2O=4Fe(OH)3 铁粉 Na+、Al3+
【解析】
红棕色A为Fe2O3,金属单质B能与强碱溶液反应,生成气体F,说明B为Al,F为H2,H为NaAlO2,溶液E中加氨水有红褐色沉淀生成,G为Fe(OH)3,A和B发生的是铝热反应,生成C为Fe,D为Al2O3,E为FeCl2。
(1)根据分析可知,物质A的化学式为Fe2O3,故答案为:Fe2O3。
(2)单质B与强碱溶液反应的离子方程式为:2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑,故答案为:2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑。
(3)溶液E(FeCl2)中加入氨水时,先生成白色沉淀L[Fe(OH)2],L最终变为红褐色沉淀G[ Fe(OH)3],化学反应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3。
(4)溶液E敞口放置容易变质,为了防止溶液E的变质,可往溶液中加入铁粉,2Fe3++Fe=3Fe2+,故答案为:铁粉。
(5)NaAlO2中加过量盐酸,离子方程式为:AlO2-+4H+= Al3++2H2O,故溶液I中所含金属离子是Na+、Al3+,故答案为:Na+、Al3+。

 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案