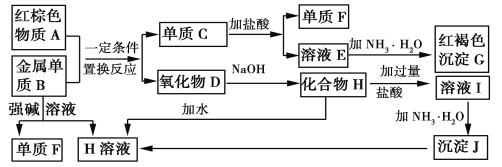
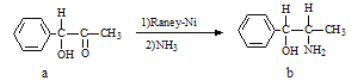
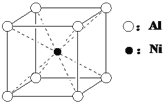
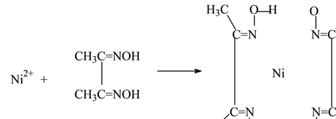题目内容
【题目】今将Fe16.8g加入到1L浓度为nmol/L的稀硝酸溶液中(假定硝酸还原产物只NO)充分反应后,Fe和HNO3均无剩余,n不可能为
A. 0.6B. 0.8C. 1.0D. 1.2
【答案】A
【解析】
将Fe16.8g加入到1L浓度为n mol/L的稀硝酸溶液中(假定硝酸还原产物只NO)充分反应后,Fe和HNO3均无剩余,则说明有两种情况讨论,第一种是铁与硝酸刚好完全反应生成硝酸铁;第二种则是铁有剩余,但又与生成的硝酸铁反应转化为硝酸亚铁,再根据关系式采用极限思想分析作答。
铁与稀硝酸可能发生反应:
①铁与硝酸刚好完全反应生成硝酸铁,其化学方程式为:Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,则n(HNO3) = 4n(Fe) =4× ![]() = 1.2 mol;
= 1.2 mol;
② Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,Fe+ 2Fe(NO3)3=3Fe(NO3)2,假设全部转化为Fe(NO3)2,则结合两式可得3Fe+8HNO3=3Fe(NO3)3+2NO↑+4H2O,所以此时n(HNO3) = ![]() n(Fe) =
n(Fe) = ![]() ×
× ![]() = 0.8 mol,若溶液中溶质为Fe(NO3)3与Fe(NO3)2,则根据N元素守恒可知,n(HNO3) > 0.8 mol,
= 0.8 mol,若溶液中溶质为Fe(NO3)3与Fe(NO3)2,则根据N元素守恒可知,n(HNO3) > 0.8 mol,
综上,硝酸的物质的量范围为:0.8 mol![]() 1.2 mol,故BCD项正确,A项不符合题意,
1.2 mol,故BCD项正确,A项不符合题意,
答案选A。

练习册系列答案
相关题目