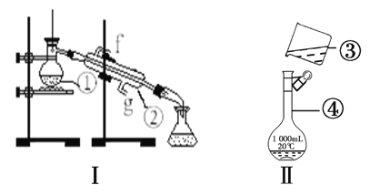
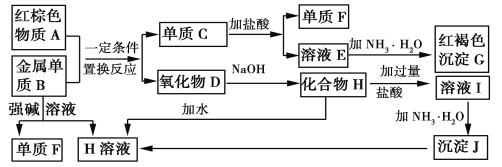
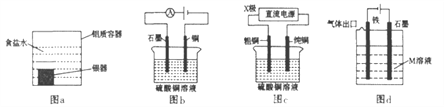
题目内容
【题目】根据反应①2FeCl3+2KI═2FeCl2+2KCl+I2,②2FeCl2+Cl2=2FeCl3,判断下列物质的氧化性由强到弱的顺序中,正确的是( )
A.Fe3+>Cl2>I2B.Cl2>I2>Fe3+C.I2>Cl2>Fe3+D.Cl2>Fe3+>I2
【答案】D
【解析】
根据氧化性的关系为:氧化剂的氧化性大于氧化产物的氧化性分析,①2FeCl3+2KI═2FeCl2+2KCl+I2,氧化剂为氯化铁,氧化产物是碘单质,故有Fe3+>I2;②2FeCl2+Cl2=2FeCl3中氧化剂为氯气,氧化产物为氯化铁,故有Cl2>Fe3+,所以有Cl2>Fe3+>I2。
故选D。

练习册系列答案
相关题目
【题目】(1)将0.5 mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5 kJ热量,该反应的热化学方程式为_______________。又已知:H2O(g)=H2O(l) ΔH2=-44.0 kJ·mol-1,则4.48 L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是__________。
(2)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇气体。已知某些化学键的键能数据如下表:
化学键 | C—C | C—H | H—H | C—O | C≡O | H—O |
键能/ (kJ·mol-1) | 348 | 413 | 436 | 358 | 1 072 | 458 |
则工业制备甲醇的热化学方程式为________________。