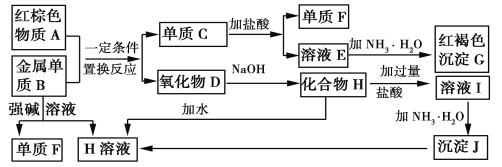
题目内容
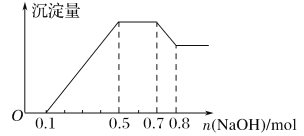
【题目】某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如下图所示。则下列说法正确的是( )
A. 溶液中的阳离子只有H+、Mg2+、Al3+
B. 溶液中n(NH4+)=0.2mol
C. 溶液中一定不含CO32-,可能含有SO42-和NO3-
D. n(H+)∶n(Al3+)∶n(Mg2+)=1∶1∶1
【答案】B
【解析】
若加入锌粒,产生无色无味的气体,说明气体是氢气,因此溶液显酸性,则CO32-和NO3-不能大量共存;加入NaOH溶液,产生白色沉淀,说明不存在铁离子;根据产生的沉淀量与加入NaOH的物质的量之间的关系图可知,溶液中一定含有Mg2+、Al3+;又因为当沉淀达到最大值时,继续进入氢氧化钠,沉淀不变,这说明溶液中还存在NH4+,其n(NH4+)=0.7mol-0.5mol=0.2mol;由于溶液中还必须存在阴离子,所以一定还有SO42。根据图可知,氢离子的物质的量时0.1mol、铝离子的物质的量是0.1mol,但镁离子是(0.5mol-0.1mol-0.3mol)÷2=0.05mol。
A.由上述分析可知,溶液中的阳离子只有H+、Mg2+、Al3+、NH4+,故A错误;
B.由上述分析可知,溶液中n(NH4+)=0.2mol,故B正确;
C.由上述分析可知,溶液中一定不含CO32-、NO3-,一定含有SO42-,故C错误;
D.由上述分析可知,溶液中n(H+):n(Al3+):n(Mg2+)=0.1mol:0.1mol:0.05mol=2:2:1,故D错误;
故选B。

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目