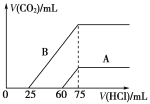
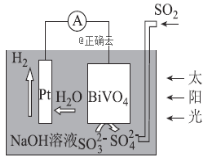
题目内容
【题目】25℃时,在25mL 0.1mol·L-1的氢氧化钠溶液中,逐滴加入0.2mol·L-1 CH3COOH溶液,溶液的pH变化曲线如图所示,下列分析结论正确的是( )
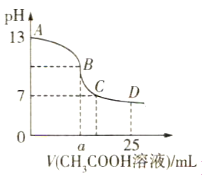
A.若B点的横坐标a=12.5,则有c(Na+)=c(CH3COO-)
B.对曲线上A、B间任意一点,溶液中都有c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
C.D点时,c(CH3COO-)+c(CH3COOH)=c(Na+)
D.C点时,c(CH3COO-)=c(Na+)>c(H+)=c(OH-)
【答案】D
【解析】
A. 若B点的横坐标a=12.5,则NaOH与CH3COOH刚好完全反应,生成CH3COONa和水,由于CH3COO-发生水解,使得c(CH3COO-)减小,所以c(Na+)>c(CH3COO-),A错误;
B. 靠近B点的位置,溶液中的溶质主要为CH3COONa,此时c(Na+)>c(CH3COO-)>c(OH-)>c(H+),B错误;
C. D点时,CH3COONa与CH3COOH物质的量相等,浓度相等,即便考虑CH3COOH电离,一定有下列关系:c(CH3COO-)+c(CH3COOH)=2c(Na+),C错误;
D. C点时,溶液为CH3COONa与CH3COOH的混合溶液,因为pH=7,所以可认为醋酸不电离,醋酸根离子不水解,从而得出:c(CH3COO-)=c(Na+)>c(H+)=c(OH-),D正确;
故选D。

 金钥匙试卷系列答案
金钥匙试卷系列答案【题目】某温度时,在10L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化下表中数据
t/min | X/mol | Y/mol | Z/mol |
0 | 1.00 | 2.00 | 0.00 |
1 | 0.90 | 1.80 | 0.20 |
3 | 0.75 | 1.50 | 0.50 |
5 | 0.65 | 1.30 | 0.70 |
9 | 0.55 | 1.10 | 0.90 |
10 | 0.55 | 1.10 | 0.90 |
14 | 0.55 | 1.10 | 0.90 |
(1)体系中发生反应的化学方程式____________;
(2)列式计算该反应在0~3 min时间内产物Z的平均反应速率:________;
(3)该反应达到平衡时反应物X的转化率α等于________;
(4)如果该反应是放热反应,改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线1、2、3(如下图所示)则曲线1、2、3所对应的实验条件改变分别是:1____________,2______________,3______________。